血管化是缺血组织修复的关键过程。然而,对于慢性伤口来说,长期缺氧微环境导致血管化不足,从而导致伤口愈合延迟。作为构成新生血管的主要细胞类型,内皮细胞在血管化过程中起着至关重要的作用。近年来,针对内皮细胞的递送策略受到广泛关注,载体主要包括脂质体和细胞外囊泡(EVs)。作为合成纳米颗粒,脂质体具有易于修饰和制备的优势,但这也不可避免地导致固有毒性。与脂质体相比,细胞外囊泡是自然细胞产物,因此具有低免疫原性和细胞毒性。但是目前常用的外泌体面临着提取步骤复杂、产量低、工程化修饰困难的问题,如何在发挥细胞外囊泡的优势的同时构建出制备简便、易于修饰的新型载体用于促进慢性创面血管化是亟待解决的问题。近日,上海交通大学医学院附属第九人民医院整复外科孙晓明博士团队构建了工程化凋亡小体纳米囊泡,通过"找-吃"策略靶向低氧微环境中的内皮细胞以增强微血管生成,为慢性创面愈合提供了新的治疗策略。相关成果以“’Find-eat’strategy targeting endothelial cells via receptor functionalized apoptotic body nanovesicle”为题, 在中国卓越计划领军期刊Science Bulletin《科学通报(英文版)》发表(2023 Apr 30;68(8):826-837)。Science Bulletin《科学通报(英文版)》是由中国科学院和国家自然科学基金委员会共同创办的自然科学综合类刊物。

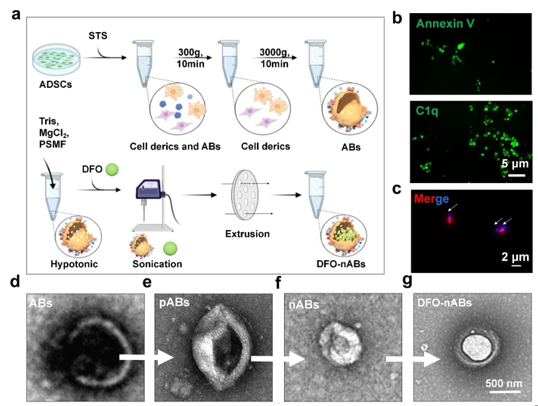
研究团队将目光对准了凋亡小体(ABs),ABs属于EVs家族,它是在凋亡细胞解体过程中通过质膜起泡和凋亡膜突起形成的具有完整外膜的囊泡。与只能通过胞饮-内吞作用发挥作用的外泌体和微囊泡相比,ABs本身可以发出“找到我”和“吃掉我”的信号,吸引具有吞噬能力的细胞(如内皮细胞)进行吞噬。“找到我”信号是由ABs表面的CX3CL1实现的,它可以通过特定的受体-配体相互作用与缺氧微环境中高表达CX3CR1的内皮细胞结合。“吃我”信号由内皮细胞膜表面的磷脂酰丝氨酸受体(PSR)和ABs膜上的磷脂酰丝氨酸(PS)介导,通过低渗-超声-挤压后的工程化凋亡小体纳米囊泡可特异性地将促血管药物递送至内皮细胞。
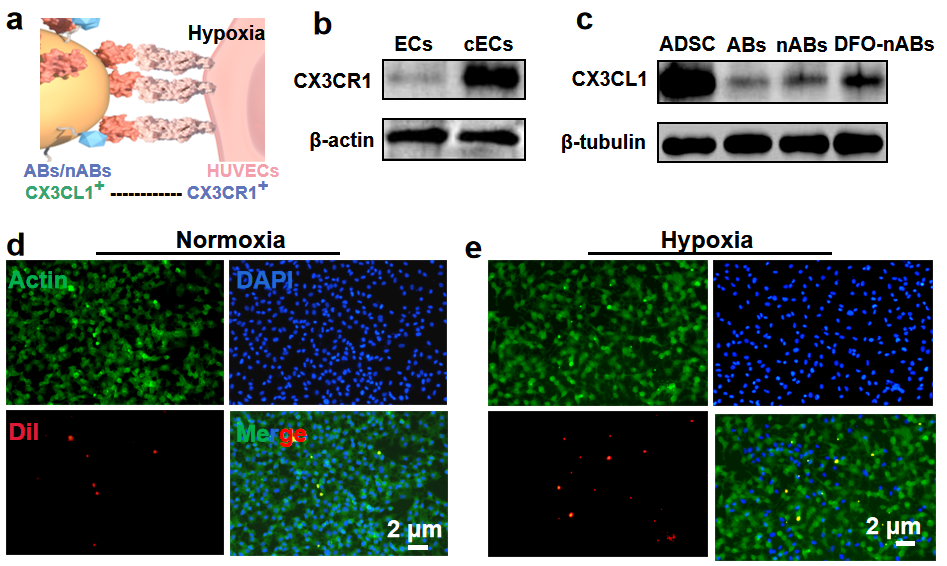
工程化凋亡小体纳米囊泡制备简单、靶向性高,具有良好的临床转化前景。上海交通大学医学院附属第九人民医院整复外科硕士研究生钱姝桐为论文第一作者,硕士研究生毛佳怡为共同第一作者。此项研究得到了国家自然科学基金、上海市科委等项目的资助。近年来,孙晓明博士团队致力于损伤修复与微血管再生的研究,旨在为治疗缺血性疾病提供新的治疗模式。
参考文献:"Find-eat" strategy targeting endothelial cells via receptor functionalized apoptotic body nanovesicle, Sci Bull (Beijing). 2023 Apr 30;68(8):826-837. doi: 10.1016/j.scib.2023.03.030.
外泌体资讯网 Science Bulletin | 上海交通大学孙晓明博士团队在工程化凋亡小体促进微血管再生研究获新成果




