外泌体作为生物标志物和药物递送工具显示出良好的前景。牛乳外泌体(mExo)因其低成本、低免疫原性、易获得性和高安全性而成为新型药物载体。肿瘤相关巨噬细胞 (TAM) 是肿瘤组织中丰度最高的免疫细胞,在诱导免疫抑制性肿瘤微环境 (TME) 和肿瘤免疫逃逸中发挥关键作用。EGFR是一种泛癌驱动因子,在多种类型肿瘤细胞表面高表达,并在某些癌症类型的TAM表达;纳米抗体可以作为修饰外泌体的新的候选分子;课题组之前揭示了PDL1(一个关键的免疫检查点)在TAM中上调并诱导了TAM M2极化,凸显了TAM中的PDL1是一个有前景的癌症免疫治疗靶点。工程化外泌体对天然外泌体进行一系列改造后具有特定功能的外泌体。近日,江南大学附属医院肿瘤研究所黄朝晖团队在国际权威期刊Journal of Controlled Release发表了题为“Reprogramming tumor-associated macrophages by a dually targeted milk exosome system as a potent monotherapy for cancer”的研究成果(2023 Nov 16:364:672-686)。博士研究生陈莹为文章的第一作者,黄朝晖研究员为论文通讯作者。
在该研究中,研究团队以mExo作为一种靶向递送材料,研发了一种由M2pep (M2型巨噬细胞结合肽)和7D12(抗EGFR纳米抗体)修饰的工程化mExo系统(7D12-mExo-M2pep-siPDL1),以特异地将siPDL1递送到M2型TAM中,抑制PDL1表达,诱导M2 TAM重编程,恢复了CD8+ T细胞的免疫活性,并重塑了TME。重要的是,7D12-mExo-M2pep-siPDL1系统给药显示出高效的单药抗肿瘤活性,并具有良好的安全性。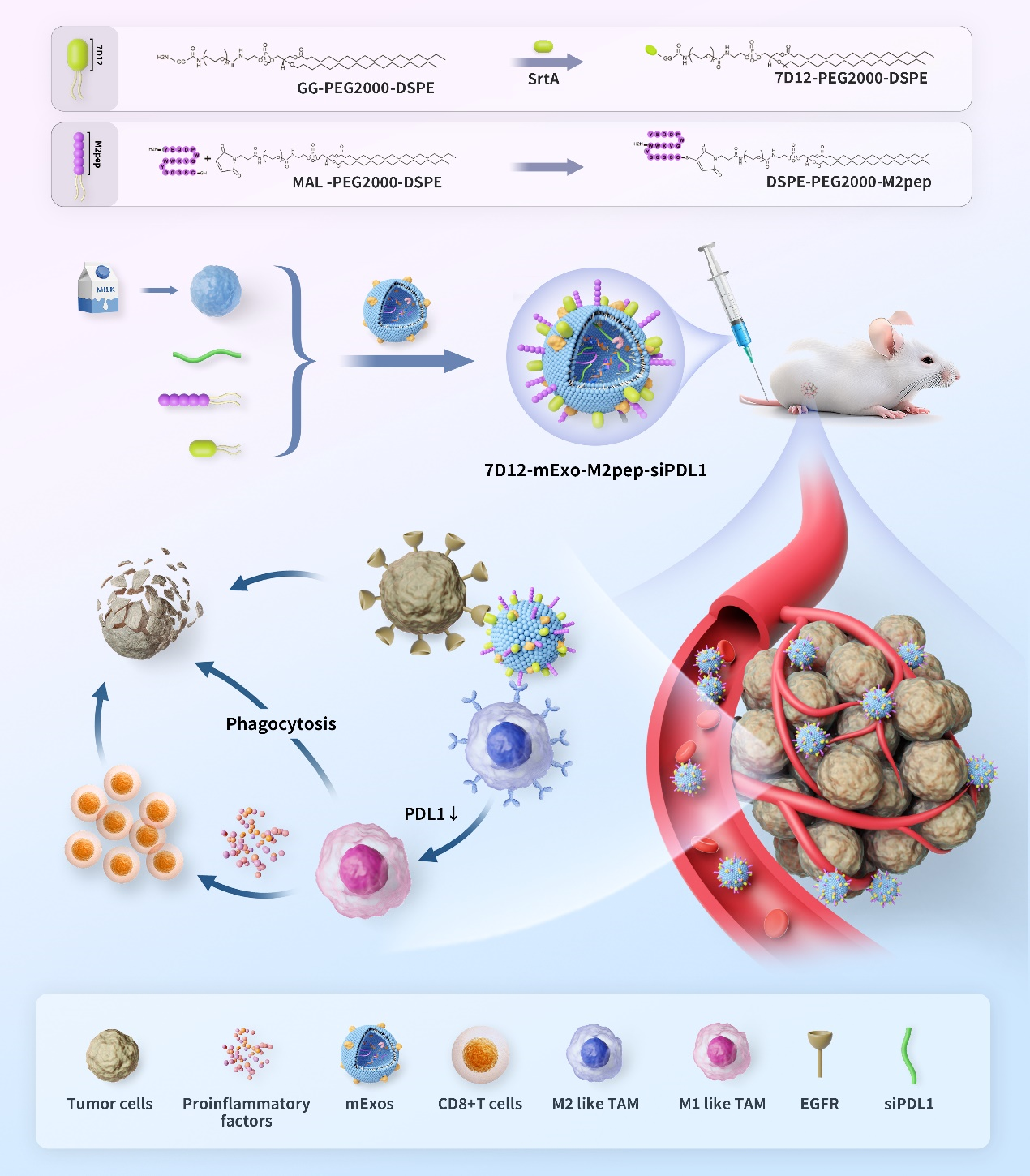
总之,这项研究开发了一种基于mExo的纳米药物系统(7D12-mExo-M2pep-siPDL1),可以特异性靶向改造EGFR阳性肿瘤的M2型TAM,使其复极化为抗肿瘤的M1型巨噬细胞,逆转抑制性TME,发挥抗癌作用,同时mExo具有低系统免疫原性、高可用性、高生物相容性和良好的安全性,显示出良好的临床应用潜力。该研究得到了江苏省重点研发计划等多个基金的资助。Reprogramming tumor-associated macrophages by a dually targeted mExo system as a potent monotherapy for cancer, J Control Release. 2024 Jan 4:366:395-409. doi: 10.1016/j.jconrel.2023.12.058.外泌体资讯网 J Control Release | 江南大学附属医院黄朝晖团队:双靶向工程化牛奶外泌体药物递送体系重编程肿瘤相关巨噬细胞