骨髓微环境中的炎症是急性髓系白血病(AML)发生的一个构成部分。目前证据表明,白血病爆发细胞和基质均分泌促炎因子,抑制健康造血干细胞和祖细胞(HSPCs)的功能。HSPCs也是先天免疫系统的细胞组成部分,因此推测它们可能传播白血病环境中的炎症反应。来自美国费城儿童医院的研究人员发现,长寿命干细胞和祖细胞群体成为BM巢穴的炎症反应组成部分,这种炎症反应受AML细胞外囊泡(EVAML)所驱动。相关研究以“Inflammatory recruitment of healthy hematopoietic stem and progenitor cells in the acute myeloid leukemia niche”为题在线发表于1月16日的国际知名医学类期刊Leukemia杂志上。
急性髓系白血病(AML)是一种基因异质性疾病,其特征是来源于造血干细胞(HSPCs)的髓系爆发克隆扩增。经过合理设计的靶向治疗已经为部分选择性AML的患者带来了有意义的改善,但许多患者仍然在治疗后复发。最近的研究表明,AML爆发细胞和骨髓(BM)基质中的炎性分泌物在AML发病机制中起到一定作用。AML微环境中的炎症信号与AML进展和造血功能障碍之间存在着联系,并提出了几种机制和介质,包括AML爆发细胞中NF-κB表达过程,以及白细胞介素(IL)-6 和IL-1β的分泌。因此,虽然AML爆发细胞(AML blasts)和白血病微环境中的基质细胞是白血病BM中炎性因子的已知来源,但其他细胞的作用尚未完全理解。重要的是,AML爆发细胞在诱导治疗中会迅速从白血病BM中消失,而基质细胞比例较少,HSPCs却在缓解后的BM中持续存在并重新扩张。HSPCs维持终身造血和免疫功能,通过将细胞自主程序与外源性微环境信号整合,在稳态和应激状态下进行适应。最近的发现表明,HSPCs作为BM中炎症的强大感应器和放大器,暗示了在传播和维持炎症状态方面可能具有持久和强大的作用。
通过几种生物发生途径生成的细胞外囊泡(EVs)是从细胞中不断释放的,对于一些组织中的细胞间通讯起到了至关重要的作用,包括BM。肿瘤来源EV的旁分泌和内分泌运输有助于组织适应并促进转移性扩散。虽然EV在常规配体-受体基础信号传导的背景下发挥作用,但使用异种移植模型的最新研究表明,纯化的AML来源细胞外囊泡(EVAML)本身就足以抑制造血祖细胞,并在基质细胞中引起未折叠蛋白应激。研究团队曾表明,长期造血干细胞(LT-HSC)逃脱了这些抑制效应,并似乎进入了由EVAML引起的可逆代谢性静止状态。
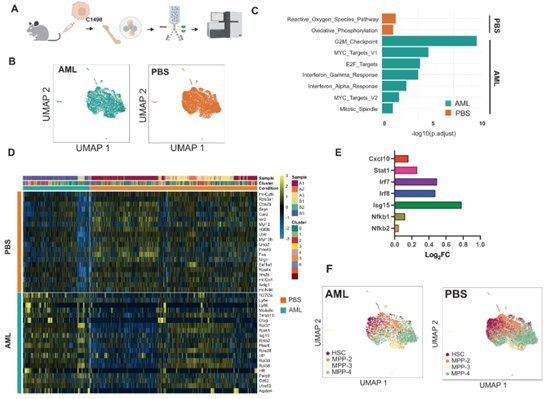
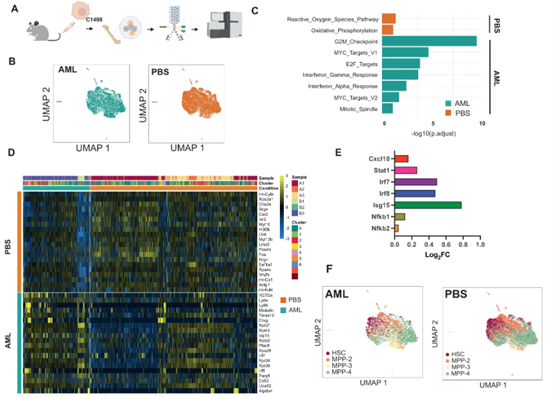
为了评估AML BM中内源性健康HSPCs的炎症激活,并克服AML异种移植的一些局限性,包括髓外(脾)造血,研究人员利用了两个同基因小鼠AML模型。在AML的两个不同的同基因模型中,研究人员通过评估BM血浆分泌组和HSPC选择性单细胞RNA测序(scRNA-Seq),证实多能祖细胞和长寿干细胞进行了炎症基因表达程序,即使在BM中白血病浸润较低的情况下。特别是,研究人员观察到干扰素γ(IFN-γ)途径激活,以及其趋化因子靶点CXCL10的分泌。研究表明,AML来源的纳米级细胞外囊泡(EVAML)足以在体外和体内触发这种炎症HSPC反应。总体而言,该研究表明,HSPCs是白血病细胞对BM炎症适应的一个未被认识的组成部分。HSPCs在BM中的促炎转化和长寿性,以及它们在缓解期间的再生性重新扩张,可能影响克隆选择和疾病演变。
参考文献:Inflammatory recruitment of healthy hematopoietic stem and progenitor cells in the acute myeloid leukemia niche. Leukemia. 2024 Jan 16. doi: 10.1038/s41375-024-02136-7.