胶质瘤干细胞在肿瘤发生、恶性进展、高度免疫抑制性肿瘤微环境 (TME) 的重构、对规范化治疗高度抵抗及治疗后短期内复发等进程中发挥重要作用。 TMZ耐药性的获得和增强收到多因素、多环节调控,不仅涉及肿瘤细胞内过程,还涉及GBM微环境中的间质细胞影响,并且 TME 间质细胞广泛参与肿瘤增殖并显着改变治疗反应和临床结果。胶质细胞,尤其是星形细胞是构建胶质母细胞瘤微环境的重要间质细胞组成部分,其与肿瘤细胞之间的活跃相互作用形成了一个复杂的串话网络,深刻影响放化疗敏感性。此外,GSC 释放的外泌体可以调节 TME 的间质细胞,从而重塑有利于胶质母细胞瘤发展的促瘤环境。
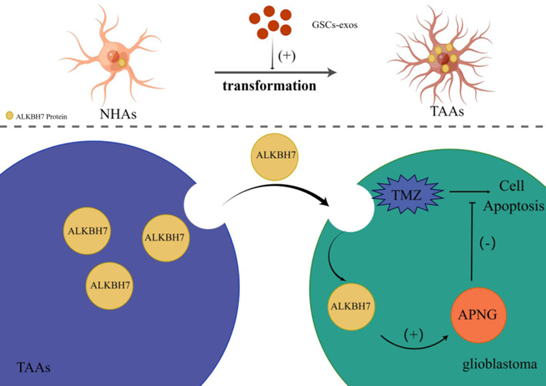
近日,苏州大学附属第二医院神经外科董军教授团队新近研究发现:胶质瘤干细胞(GSC)分泌的外泌体能够重塑脑星形细胞为肿瘤相关星形细胞(TAA),后者通过传递α-酮戊二酸依赖性二氧化酶 AlkB 同源体 7(ALKBH7)来增强胶质母细胞瘤(GBM)细胞烷基嘌呤-DNA-N-糖基化酶(APNG)的表达,从而赋予GBM对胶质瘤一线化疗药物替莫唑胺(TMZ)耐药性。相关研究以“Transformed astrocytes confer temozolomide resistance on glioblastoma via delivering ALKBH7 to enhance APNG expression after educating by glioblastoma stem cells-derived exosomes”为题,发表在CNS Neurosci Ther杂志上(2024,30(2):e14599)。
该项研究探讨了成人最为恶性且难治性的原发性脑肿瘤——胶质母细胞瘤在临床治疗中面临的重大挑战,该肿瘤表现出高度的治疗抵抗性。替莫唑胺(TMZ)作为胶质瘤首选化疗药物,由于肿瘤普遍存在多种药物抵抗机制,在临床上的疗效极其受限,而相关分子调控机制目前仍未完全阐明。该研究初步探索由胶质瘤干细胞分泌的外泌体(GSCs-exos)重塑的肿瘤相关星形细胞(TAAs)在促进胶质母细胞瘤对TMZ抵抗中的作用,揭示了GSCs-exos诱导星形细胞转变为促瘤性TAAs。值得注意的是,TAAs的分泌蛋白Alpha-Ketoglutarate-Dependent Dioxygenase AlkB Homolog 7(ALKBH7)的表达上调,ALKBH7可以在TAAs与GBM细胞之间进行相互作用,增强GBM细胞内耐药相关蛋白APNG的表达,而另一耐药相关蛋白MGMT的表达未受影响。沉默APNG能够提高TMZ对GBM细胞生存的抑制效果。体内实验进一步证实了ALKBH7参与增强胶质母细胞瘤对TMZ的抵抗。该研究提示GNM对TMZ耐药的一种新机制,即经过GSCs-exos重塑的TAAs通过调控ALKBH7来增强胶质母细胞瘤的APNG表达,从而增强其TMZ抵抗性,因此针对这一分子调控机制有潜力作为对抗GBM化疗抵抗的新策略。
参考文献:
Transformed astrocytes confer temozolomide resistance on glioblastoma via delivering ALKBH7 to enhance APNG expression after educating by glioblastoma stem cells-derived exosomes, CNS Neurosci Ther. 2024, 30(2):e14599. doi: 10.1111/cns.14599.
外泌体资讯网 CNS Neurosci Ther | 苏州大学附二院董军教: 胶质瘤干细胞外泌体促进胶质母细胞瘤对化疗药物替莫唑胺的耐药性





