前列腺癌(prostate cancer, PCa)是男性常见的恶性肿瘤,其发病率位列中国男性泌尿系统肿瘤的第一位。去势抵抗性前列腺癌 (Castration- Resistant Prostate Cancer, CRPC) 是它的一种晚期且更为危险的形态,也是导致PCa相关死亡的主要原因。细胞外囊泡(extracellular vesicles, EVs)通过传递各种分子调节受体细胞的生物学过程,参与CRPC的发生、发展和耐药。这些EVs不仅来源于恶性细胞,也来源于肿瘤微环境(tumor microenvironment, TME)中的多种细胞类型。EVs广泛分布于各种生物体液中,是无创性液体活检技术领域极具潜力的生物标志物,此外,外源性EVs可能为开发CRPC新的治疗手段提供工具。EVs在CRPC中的作用机制以及其潜在的临床应用价值亟待讨论。近日,陆军军医大学第二附属医院泌尿外科郑霁教授/孙碧韶主治医师全面介绍了不同细胞来源的EVs在CPRC进展过程中的作用机制,总结归纳了EVs作为CPRC诊断、预后、治疗响应的生物标志物的研究进展,讨论了EVs作为潜在的CPRC治疗靶点以及药物递送系统的可能性,展望了未来EVs在CPRC治疗方面可能的应用;同时批判性地指出了目前EVs富集方法存在的一些不足,以及大量基础研究无法实现临床转化的痛点。相关研究内容以”Role of Extracellular Vesicles in Castration-Resistant Prostate Cancer”为题于4月6日在线发表在最新一期的国际肿瘤学权威期刊Critical Reviews in Oncology/Hematology杂志上(2024 Apr 6:104348.)。
EVs在激素敏感型PCa向CRPC的转变过程中发挥重要作用,这主要归因于其复杂的分子调控。CPRC的核心机制是重新激活雄激素受体(androgen receptor, AR)通路及其下游通路,除了AR通路的再激活外,EVs还诱导受体细胞的表型改变,导致PCa细胞增殖、侵袭、免疫逃逸、药物外排增加,以及TME对应的细胞重塑。这些改变共同促进了向去势抵抗状态的转化。CRPC细胞往往向低恶性的PCa细胞转递EVs从而导致雄激素非依赖表型的转移,CPRC细胞与TME的多种组成细胞均有相互作用导致TME的重塑,更有利于CRPC进展。除此之外,EVs的分泌量也与CPRC相关,抑制EVs的生成与分泌可以有效抑制癌症进展。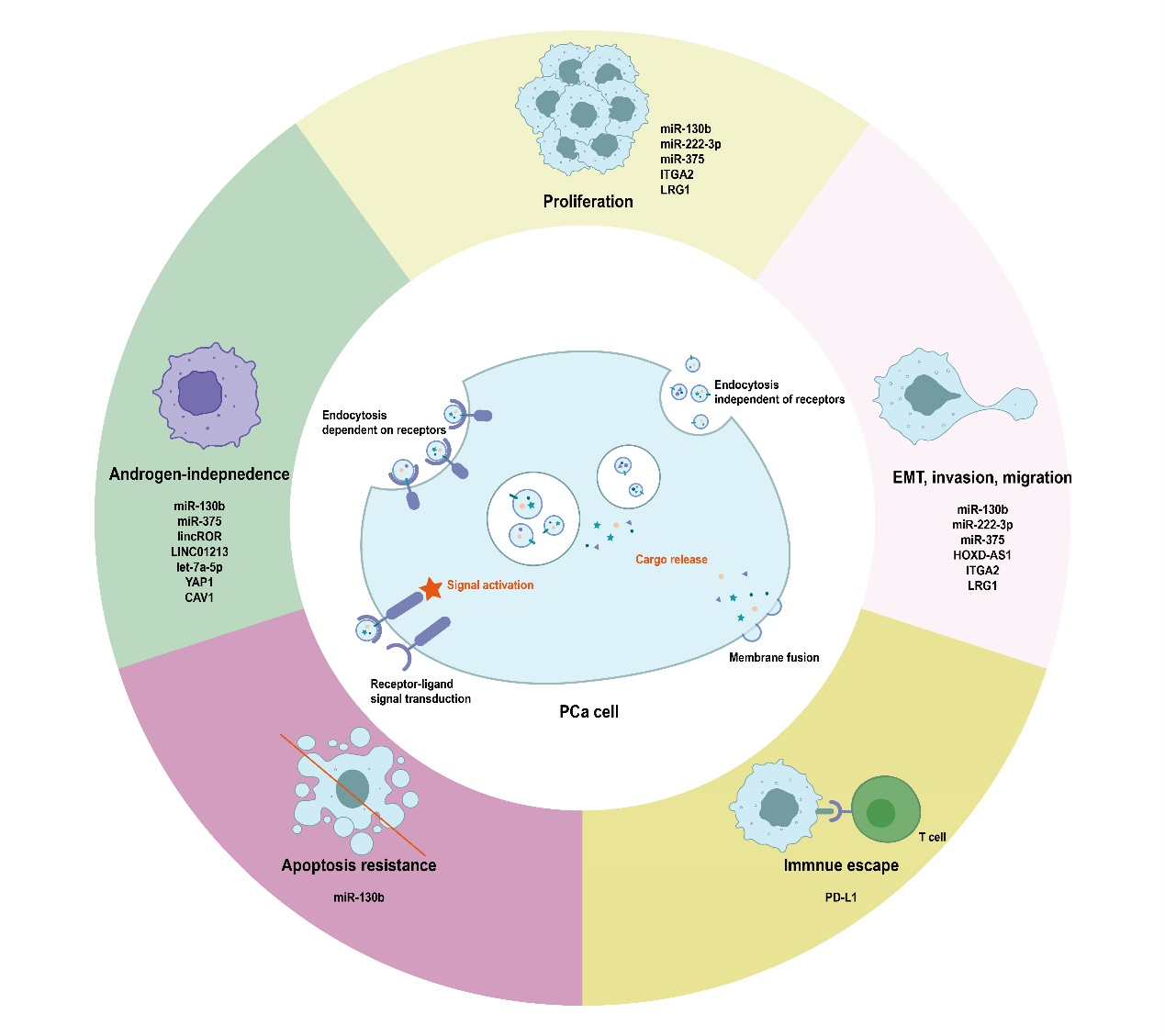 图1. EVs通过多种机制介导CRPC相关的细胞间通讯相较于循环肿瘤细胞与游离肿瘤DNA,EVs以其高丰度、长半衰期,成为一种更具潜力的生物标志物。目前已有许多研究纳入临床大样本CRPC队列,利用EVs探究新型CPRC诊断、进展、预后及治疗响应的标志物。本文详细介绍了不同分离方法获得的EVs包裹的生物标志物分子以及他们的预测效能。除了免疫捕获以外,目前CRPC相关研究中缺乏富集肿瘤特异性来源的EVs的方法,分析体液中的总EVs会对结果造成不同程度的偏倚,已有研究者开始聚焦于新型EVs分离方法以富集肿瘤来源的EVs。
图1. EVs通过多种机制介导CRPC相关的细胞间通讯相较于循环肿瘤细胞与游离肿瘤DNA,EVs以其高丰度、长半衰期,成为一种更具潜力的生物标志物。目前已有许多研究纳入临床大样本CRPC队列,利用EVs探究新型CPRC诊断、进展、预后及治疗响应的标志物。本文详细介绍了不同分离方法获得的EVs包裹的生物标志物分子以及他们的预测效能。除了免疫捕获以外,目前CRPC相关研究中缺乏富集肿瘤特异性来源的EVs的方法,分析体液中的总EVs会对结果造成不同程度的偏倚,已有研究者开始聚焦于新型EVs分离方法以富集肿瘤来源的EVs。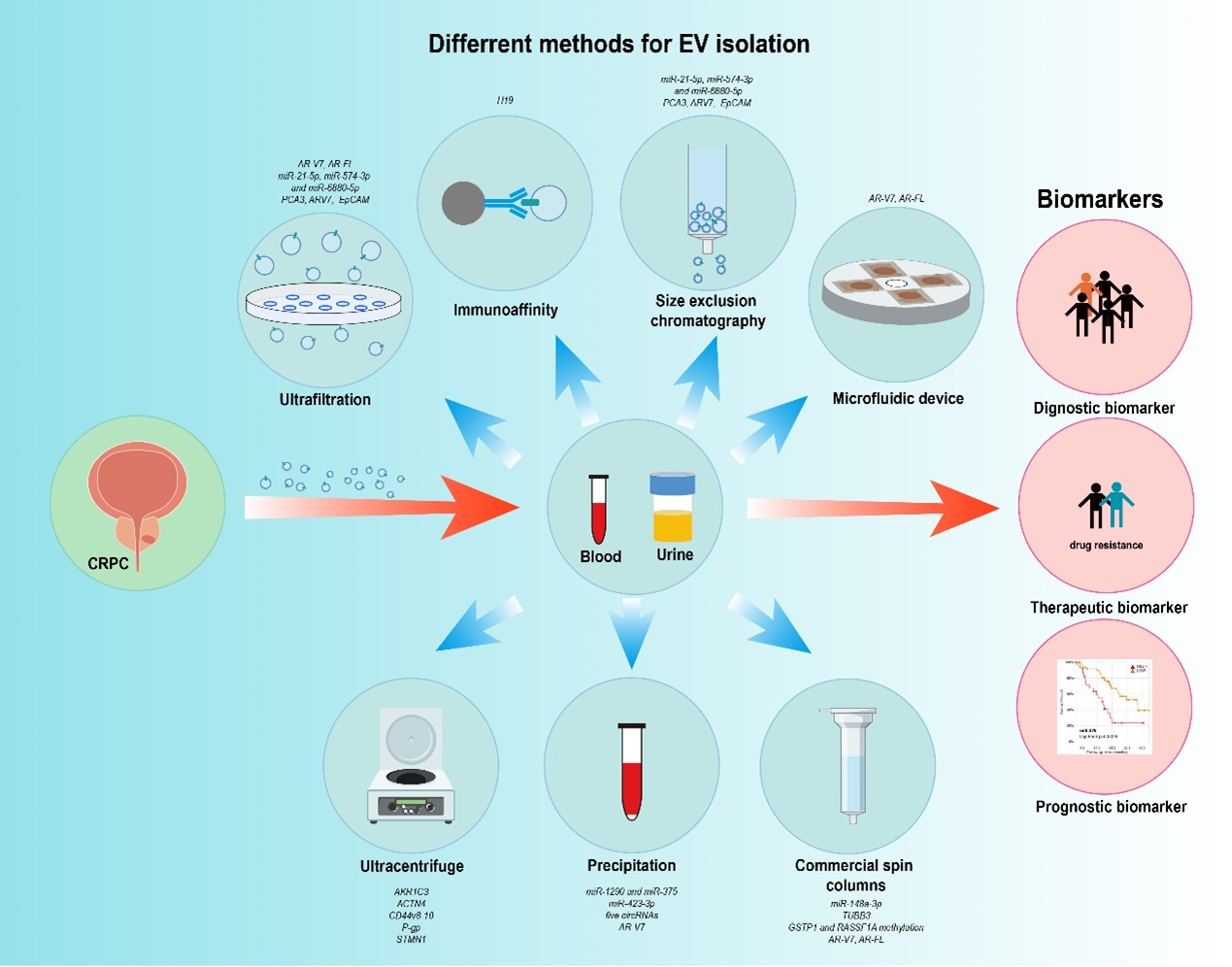 图2. 多种分离策略得到的EVs作为新的CRPC生物标志物EVs层面的组学分析为阐释CPRC的发生发展提供了新的维度,EVs研究中鉴定出了许多新的致病分子,它们都有可能成为CRPC治疗的新型靶点。除此之外,EVs具有良好的生物相容性、低免疫原性、低毒性、生物可降解性、在外周血中的半衰期长以及能够跨越各种生物屏障,这些特性让EVs可作为良好的药物递送载体。但是这些研究结果很少有进入临床验证的阶段,我们批判性的指出:有关EVs内含物对于CPRC作用机制的研究大多局限于细胞系上进行实验,难以模拟CRPC患者的真实情况,肿瘤异质性使得为CPRC患者提出普适的治疗靶点成为挑战。关于载药平台的研究,尽管已有小鼠体内实验证实疗效,但人体对于EVs载药平台的耐受度尚未确定,以及EVs的高异质性使得其难以量产以投入临床使用。陆军军医大学第二附属医院廖朝宇博士为本文的第一作者。该工作得到了重庆市中青年医学高端人才项目、陆军军医大学临床创新重点项目及第二附属医院学科人才建设专项的支持。
图2. 多种分离策略得到的EVs作为新的CRPC生物标志物EVs层面的组学分析为阐释CPRC的发生发展提供了新的维度,EVs研究中鉴定出了许多新的致病分子,它们都有可能成为CRPC治疗的新型靶点。除此之外,EVs具有良好的生物相容性、低免疫原性、低毒性、生物可降解性、在外周血中的半衰期长以及能够跨越各种生物屏障,这些特性让EVs可作为良好的药物递送载体。但是这些研究结果很少有进入临床验证的阶段,我们批判性的指出:有关EVs内含物对于CPRC作用机制的研究大多局限于细胞系上进行实验,难以模拟CRPC患者的真实情况,肿瘤异质性使得为CPRC患者提出普适的治疗靶点成为挑战。关于载药平台的研究,尽管已有小鼠体内实验证实疗效,但人体对于EVs载药平台的耐受度尚未确定,以及EVs的高异质性使得其难以量产以投入临床使用。陆军军医大学第二附属医院廖朝宇博士为本文的第一作者。该工作得到了重庆市中青年医学高端人才项目、陆军军医大学临床创新重点项目及第二附属医院学科人才建设专项的支持。外泌体资讯网 CRIT REV ONCOL HEMAT: 陆军军医大学第二附属医院郑霁/孙碧韶团队:细胞外囊泡在去势抵抗性前列腺癌中的作用
 图1. EVs通过多种机制介导CRPC相关的细胞间通讯
图1. EVs通过多种机制介导CRPC相关的细胞间通讯 图2. 多种分离策略得到的EVs作为新的CRPC生物标志物
图2. 多种分离策略得到的EVs作为新的CRPC生物标志物 图1. EVs通过多种机制介导CRPC相关的细胞间通讯
图1. EVs通过多种机制介导CRPC相关的细胞间通讯 图2. 多种分离策略得到的EVs作为新的CRPC生物标志物
图2. 多种分离策略得到的EVs作为新的CRPC生物标志物