包膜病毒对人类健康构成了重大威胁,最近的COVID-19大流行就是一个证明。尽管当前的疫苗策略在预防病毒感染方面已被证明是有效的,但开发创新的疫苗技术对于加强我们抵御未来大流行的防御至关重要。近日,JEV杂志上发表一篇文章,介绍了一种名为细胞工程化病毒模拟纳米囊泡(VNVs)的新平台,并展示了它们作为针对包膜病毒的疫苗的潜力。
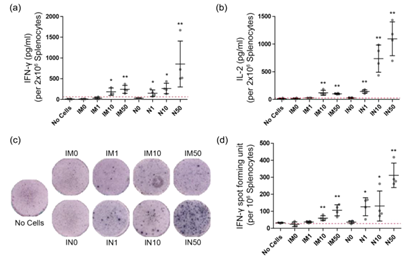
近年来,病毒性传染病的发生越来越频繁,其中具有跨物种传播能力的人畜共患病毒在这些疫情中扮演了重要角色。具有外部脂质双层膜结构(即病毒包膜)的包膜病毒特别容易发生跨物种传播。因此,开发有效的技术来对抗包膜病毒对于为未来的健康危机做准备至关重要。疫苗接种是预防病毒感染最有效和广泛采用的策略。传统疫苗根据其病毒复制能力被分类为活疫苗或非活疫苗。然而,不管它们的作用机制如何,所有疫苗都旨在安全地触发对病毒抗原的免疫反应,从而提供对病毒感染的保护。近年来,基于纳米技术和生物技术的疫苗平台有了重大发展,为疫苗设计提供了有希望的方法。在这些进步中,核酸疫苗,特别是mRNA疫苗,代表了最新的突破。这些疫苗提供了几个关键的好处,包括快速的疫苗开发和生产,以及与现有疫苗相比的优越保护。然而,这些疫苗通常需要特定的储存和运输条件,导致高成本和在偏远地区的可及性有限。因此,多样化疫苗技术对于解决这些限制和更好地为未来的大流行做准备至关重要。病毒样颗粒(VLPs)构成了另一种有前景的疫苗技术。这些颗粒模仿目标病毒的整体结构,并结合了多个病毒抗原。与活疫苗或灭活病毒疫苗不同,VLPs不含有病毒基因组材料,使它们成为更安全的疫苗选择。此外,VLPs比抗原亚单位疫苗具有更优越的免疫原性,因为它们的天然病毒样结构和抗原构型与活病毒非常相似。尽管一些基于衣壳病毒的VLP疫苗在商业上取得了成功,但针对包膜病毒的VLP疫苗的开发大多仍处于临床试验阶段。这可能是由于技术挑战,如生产力和异质性问题。只有少数针对包膜病毒的VLP疫苗开发成功,例如使用非包膜VLPs的乙型肝炎病毒疫苗,这些VLPs仅由病毒核心蛋白组成(例如,乙型肝炎表面抗原(HBsAg)),没有脂质膜结构。值得注意的是,最近批准上市的COVID-19疫苗NVX-CoV2373是一种重组纳米颗粒疫苗,缺乏脂质膜结构。然而,迄今为止还没有成功开发出具有天然脂质膜结构的包膜VLP疫苗。利用天然或人工制造的脂质纳米囊泡的新型疫苗平台已成为包膜VLPs的可行替代品。这项技术的一个成功例子是病毒体(virosome),它是通过使用从洗涤剂溶解的包膜病毒中提取的病毒蛋白和脂质重组脂质纳米囊泡而创建的。病毒体与包膜病毒和VLPs非常相似,使其成为对抗包膜病毒的有效疫苗技术。然而,病毒体的生产需要能够处理传染性病毒的设施,限制了其可扩展性和广泛应用。另一方面,基于细胞外囊泡(EV)的疫苗构成了另一个有前景的平台,利用天然分泌的EVs的结构特性,这些EVs与包膜病毒相似,目前正在对天然分泌和工程化EVs进行积极研究。然而,开发基于EV的疫苗涉及复杂的蛋白质工程过程,以将病毒蛋白整合到EVs中。此外,大多数基于EV的技术面临着生产率低的挑战,因此这些技术并不被认为是包膜VLP技术的充分替代品。该研究开发了一种新型疫苗,利用了从细胞质膜中衍生出的病毒样纳米囊泡(VNVs)。这些VNVs的囊泡结构类似于天然包膜病毒,因此能够有效诱导免疫反应。VNVs是通过从体外细胞培养中稳定表达病毒抗原的细胞质膜泡生成的。通过广泛的特性分析,确认VNVs富含细胞质膜材料,同时不含其他细胞器的材料。此外,与同一细胞系自然分泌的EVs相比,VNVs表现出更优越的病毒抗原整合和表达均一性。为评估VNVs作为疫苗的临床前潜力,通过肌肉注射(IM)或鼻内注射(IN)途径向小鼠注射了一种含有严重急性呼吸综合征冠状病毒2(SARS-CoV-2)VNVs和佐剂的VNV疫苗溶液。接着评估了它们诱导抗SARS-CoV-2 S糖蛋白(S)的体液和细胞反应的能力。该疫苗成功诱导了产生特异性S IgG和IgA抗体,这些抗体中和了S蛋白与人类血管紧张素转化酶2(hACE2)受体的结合。此外,从接种小鼠中分离的脾细胞表现出特异性的干扰素-γ和IL-2细胞因子反应,表明VNV疫苗成功诱导了细胞免疫反应。在小鼠中的临床前评估成功地展示了VNVs作为预防包膜病毒感染的疫苗的临床潜力。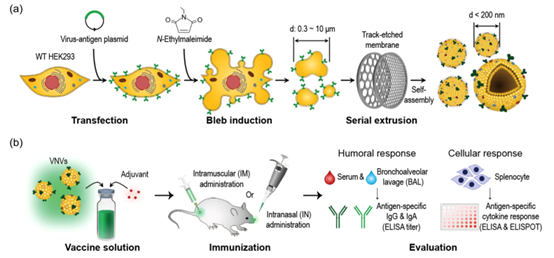
病毒模拟纳米囊泡(VNV)的生产及其在疫苗接种中的应用(a)病毒模拟纳米囊泡(VNV)生产的示意图,包括细胞系生产、泡诱导和尺寸减小步骤。 (b) VNV疫苗接种动物研究的示意图,包括疫苗配方、免疫接种和免疫评估。VNVs是通过将衍生自质膜的泡通过纳米级膜过滤器挤压而生成的。这些VNVs在大小和形态上与包膜病毒和细胞外囊泡(EVs)非常相似,密集地包含了质膜内容物,且不含来自其他膜性细胞器的物质。由于这些特性,VNVs比表达相同抗原的EVs更广泛、更均匀地表达病毒膜抗原。该研究生产了表达SARS-CoV-2刺突糖蛋白(S)的SARS-CoV-2 VNVs,并评估了它们作为COVID-19疫苗在实验动物中的临床前效力。VNVs的给药成功地刺激了系统性和局部的S特异性抗体的产生,并且从接种疫苗的小鼠中分离出的免疫细胞显示出对S刺激的细胞因子反应。Han C, Kim S, Seo Y, Lim M, Kwon Y, Yi J, Oh SI, Kang M, Jeon SG, Park J. Cell-engineered virus-mimetic nanovesicles for vaccination against enveloped viruses. J Extracell Vesicles. 2024 Apr;13(4):e12438. doi: 10.1002/jev2.12438. PMID: 38659363; PMCID: PMC11043678.
外泌体资讯网 JEV:用于针对包膜病毒疫苗接种的细胞工程病毒模拟纳米囊泡