细胞外囊泡(EVs)已成为治疗应用和药物递送的有前景的工具。EVs能够将效应分子,包括蛋白质、RNA甚至DNA,从供体细胞转移到受体细胞,从而调节细胞反应。基于RNA的治疗,包括miRNA、mRNA、lncRNA和circRNA,在控制基因表达和治疗一系列疾病方面具有巨大潜力。封装在EV中的RNA免受细胞外降解,使其在治疗应用中极具吸引力。理解EV内部货物装载和转移的复杂生物学是开发其治疗潜力的关键。近日,JEV杂志发表一篇综述,讨论了EV的生物生成和分类,将RNA加载到EV中的方法,它们作为药物载体相比合成脂质系统的优势,以及在治疗神经退行性疾病、癌症和病毒感染中的潜在应用。值得注意的是,EV在跨越血脑屏障和针对肿瘤细胞方面显示出递送RNA货物的潜力,为这些情境中基于RNA的治疗提供了一种安全有效的方法。
EVs作为药物递送载体的优势
合成脂质材料,包括脂质体和脂质纳米颗粒(LNPs),长期以来一直被用于药物递送。LNPs 是一种尺寸与小型细胞外囊泡相似的合成颗粒。脂质体和LNPs 能够封装亲水性和疏水性药物,并且可以通过改变其配方来增强其稳定性和血液循环半衰期。著名的基于脂质的药物载体包括抗癌药物多西他赛脂质体注射液(Doxil)以及辉瑞BioNTech和Moderna的mRNA疫苗。然而,脂质体和LNPs 面临着清除、巨噬细胞摄取和免疫反应等挑战。为了改善其稳定性和血液循环半衰期,已经采用了一些修改措施,例如加入胆固醇和使用聚乙二醇等聚合物涂层。
与合成载体相比,诸如外泌体等EV被认为具有较低的免疫原性。EV在小型动物研究中已显示出安全性,系统效应最小,体重或血液参数也没有显著偏差。人类试验迄今也显示了来自各种细胞源的EV静脉注射的安全性方面的有希望的结果。
此外,EV在跨越生物屏障方面表现出独特的能力,无论是在细胞层面还是组织层面。它们通过多种途径被细胞高效摄取,与脂质体配方相比,显示出增强的细胞摄取能力。在组织层面,EV能够穿越血脑屏障(BBB),这对许多合成颗粒来说是一个挑战,从而为针对难以到达的器官(如大脑)的靶向药物递送开辟了可能性。此外,EV可以通过母细胞生物工程化来生产治疗剂,解决与生物制品相关的复杂制造挑战。
由于其自然特性、低免疫原性以及针对特定细胞和跨越生物屏障的能力,EV作为药物递送载体具有巨大的应用前景。虽然基于脂质的载体如脂质体和LNPs具有其优点,但EV提供了独特的优势,并正在被探索用于各种治疗应用。
装载RNA的方法
RNA在EV中的封装是一个复杂且选择性的过程,涉及特定的机制和分选信号,并且主要通过两种方法进行:内源性封装和外源性封装。理解EV中的RNA封装和分选机制对于揭示EV介导的RNA转移的功能影响至关重要。
外源性装载
EV可以在从目标细胞分离出来之后,通过与货物被动孵育或通过电穿孔、声波处理或冻融循环等主动加载方法外源性地加载(图1)。电穿孔被考虑用于药物加载到EV中,但可能导致不良的形态变化,如聚集。外源性加载适用于理想载体是小分子药物或细胞不能生产的其他分子的情况。Santos等人展示了外源性加载miR-195-5p(肿瘤抑制miRNA)到EV中可以增强其抗肿瘤活性。这些修改后的EV被肿瘤细胞吸收后,可以减少细胞增殖,增加细胞死亡,并改善黑色素瘤中针对B-raf原癌基因突变患者的靶向治疗反应,展示了基于EV的策略增强临床结果的潜力。
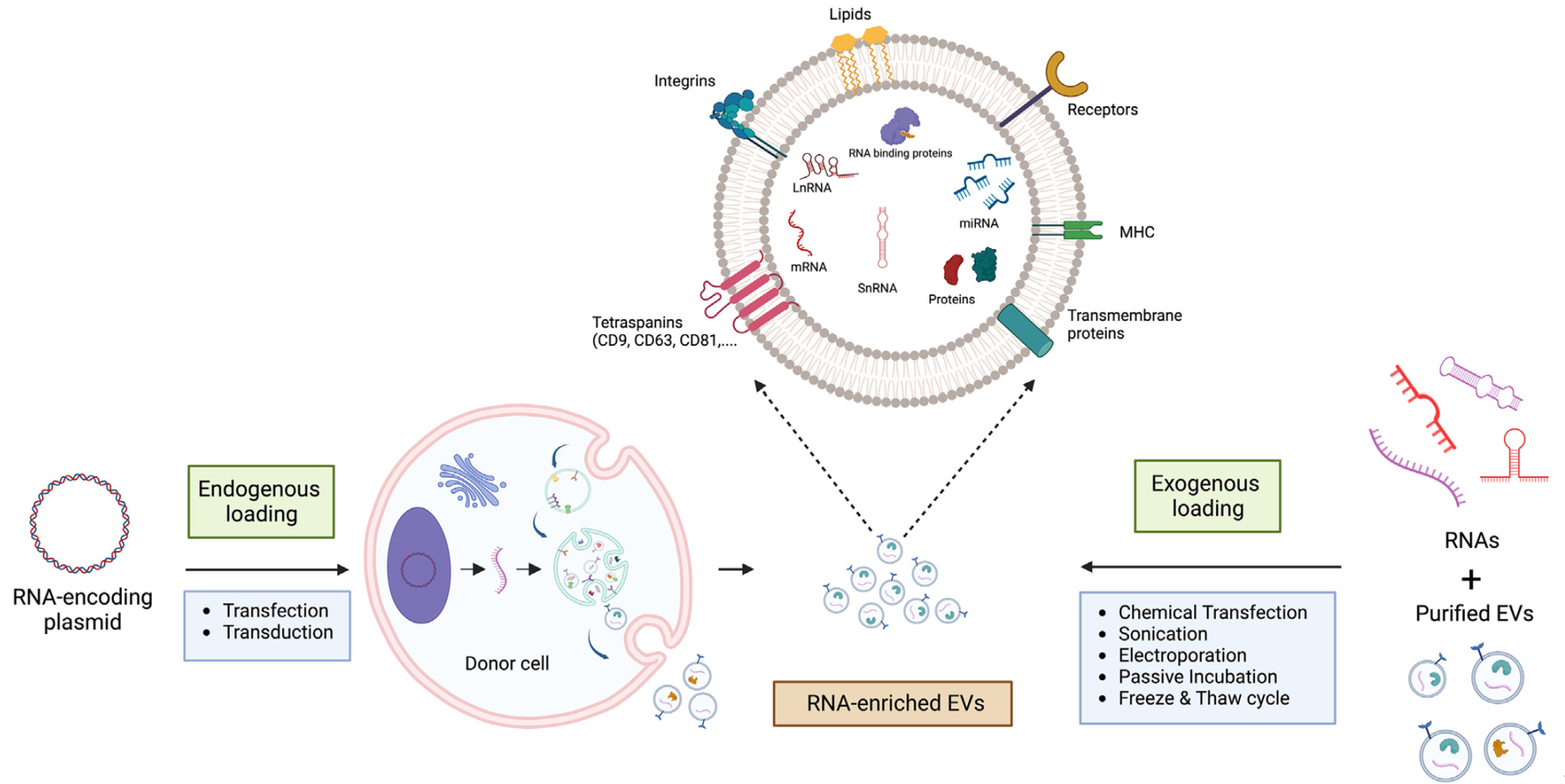
基于EV的RNA递送系统在疾病治疗中的发展
内源性装载
内源性加载涉及在母细胞中遗传过表达以产生带有所需载体的EV,导致细胞质RNA浓度高,随后被包装进EV(图1)。这种方法允许对载体内容进行更精确的控制,并已被用于将治疗性蛋白、RNA和CRISPR/Cas9复合体加载到EV中。研究已探索了将不同类型的RNA(包括miRNA、mRNA片段、siRNA和circRNA)包装进EV的各种机制。
特定miRNA被选择性地包装进外泌体的过程受到各种分选机制的影响,这些机制涉及RNA结合蛋白(如异质核糖核蛋白A2/B1、argonaute 2、YBX-1等)和膜蛋白(如caveolin-1和中性鞘糖脂酶2)在外泌体生物合成过程中的作用。这些机制影响外泌体中miRNA的含量,可以被用于各种生物效应。例如,YBX-1与miR-133在内皮祖细胞衍生的外泌体中的分选有关,导致心脏成纤维细胞中miR-133水平增加。此外,转录后修饰,如3'端尿苷化,也有助于直接将miRNA分选到EV中。
Valadi等人是最早发现外泌体自然携带mRNA的学者之一。然而,将外源mRNA整合进EV中一直面临挑战,因为电穿孔或化学方法效率不高。Tsai等人开发了一种外泌体-脂质体混合体,用于高效的mRNA转染。在研究中,他们首先用聚阳离子脂质涂层处理纯化的mRNA,然后将其与等量的纯化外泌体结合。这种方法成功地开发了一种多重mRNA COVID-19疫苗。此外,Kojima等人开发了“EXOtic(外泌体转入细胞)”平台,以增强EVs,特别是外泌体的关键属性。他们基因操作母细胞以增加外泌体的产量并促进高效的mRNA包装。该系统涉及过表达基因(STEAP3、SDC4、NadB)以增加外泌体产量,并将核糖体蛋白L7Ae与CD63结合,后者能够结合C/D box RNA结构。C/D box基序附着到目标mRNA上。connexin 43的过表达有助于细胞质内mRNA的传递。这些设计的外泌体有效地将过氧化氢酶mRNA传递到帕金森病小鼠的大脑中,减轻神经炎症,并展示了基因工程EVs用于基于RNA的治疗应用的潜力。
siRNA是一种小型非编码RNA分子,能够沉默基因表达;由于它们的亲水性,在进入细胞内方面面临挑战。为了将siRNA加载到EV中,开发了各种方法,包括电穿孔、氯化钙介导的转染、超声波处理,以及使用疏水性修饰的siRNA。由于siRNA的小尺寸(20-25个核苷酸),它们可以容易地被加载到EV中。Alvarez-Erviti及其同事是最早确认使用外泌体递送siRNA的概念的研究者之一,他们通过电穿孔将外源性siRNA加载到外泌体中,实现了在体外和体内对beta位点APP切割酶1基因的敲减。还有几项其他研究也利用电穿孔将siRNA加载到外泌体中。每种方法在效率和潜在免疫刺激方面都有其优势和局限性。此外,siRNA可以通过在产生EV的细胞的细胞质中表达预先加载到EV中,为基因沉默提供了一种多功能的方法。
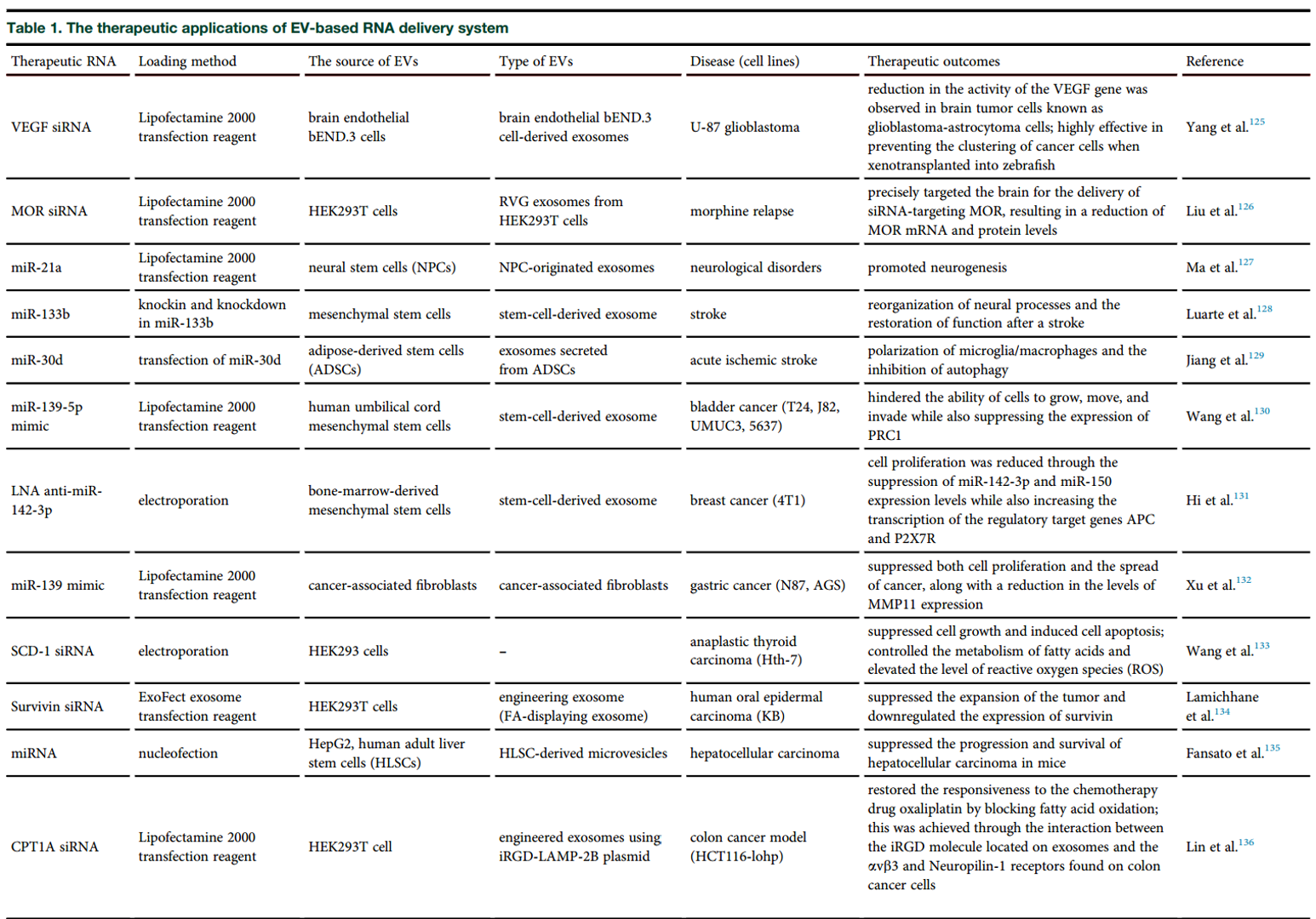
该综述还包括以下内容:EV的吸收(卸载货物)、利用RNA富集的EV治疗疾病、挑战与未来展望。
参考文献:Muskan, M., et al. (2024). "Therapeutic potential of RNA-enriched extracellular vesicles: The next generation in RNA delivery via biogenic nanoparticles." Mol Ther.
外泌体资讯网 【Mol Ther】综述:细胞外囊泡递送RNA的治疗潜力





