外泌体是直径约30到150纳米的分泌囊泡,在人类健康和疾病中发挥着重要作用。为了更好地理解细胞如何释放这些囊泡,来自美国约翰·霍普金斯大学的研究人员研究了最丰富的人类外泌体标记蛋白——外泌体四次跨膜蛋白CD81、CD9和CD63的生物发生过程。结果显示,内吞作用抑制这些蛋白的囊泡分泌,并且CD9和CD81触发内吞作用的破坏。此外,外泌体生物发生因子syntenin通过阻止CD63的内吞作用推动CD63的囊泡分泌,并且其他内吞作用抑制剂也诱导CD63的质膜积累和囊泡分泌。最后,CD63是内吞作用的表达依赖性抑制剂,可触发溶酶体蛋白和clathrin适配蛋白AP-2 mu2的囊泡分泌。这些结果表明,外泌体标记蛋白的囊泡分泌主要通过一条独立于内吞作用的途径进行。相关内容以“Endocytosis blocks the vesicular secretion of exosome marker proteins”为题在线发表于5月10日的国际知名综合性学术期刊Science Advances杂志上。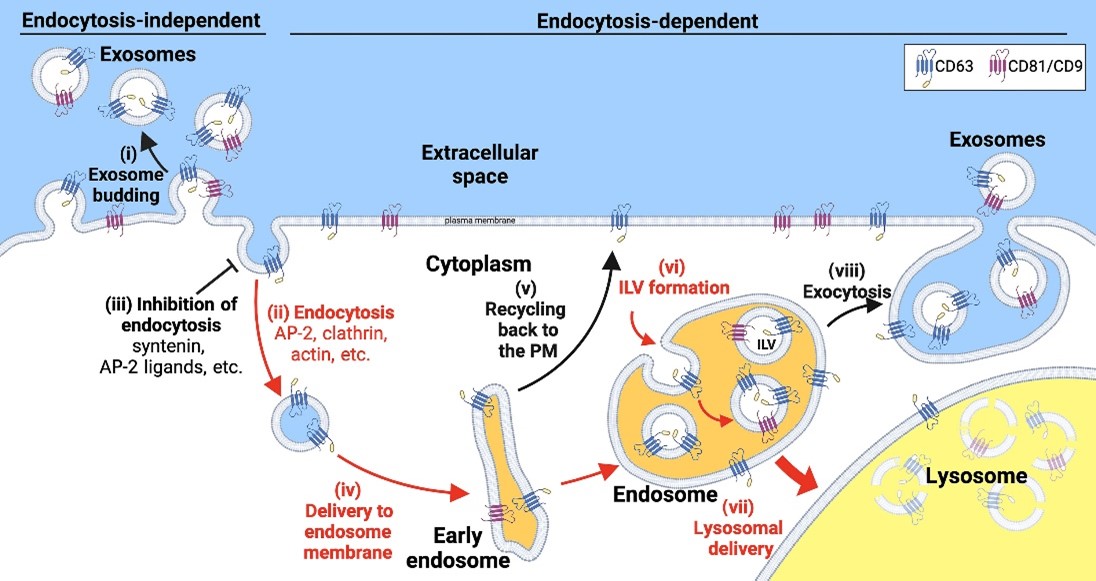
外泌体是直径约30到150纳米的小型细胞外囊泡,与细胞具有相同的拓扑结构,并且富集了一系列特定的外泌体标记蛋白,特别是外泌体四次跨膜蛋白。在哺乳动物中,外泌体在所有生物流体中丰富存在,可以在细胞之间传递信号和分子,并且已被认为参与了广泛的生理和疾病过程。此外,所有细胞类型普遍产生外泌体和其他小型细胞外囊泡,使它们可以用作组织和器官健康或疾病的生物传感器,而外泌体的生物正常性使其成为传递疫苗、生物制品和其他药物的理想纳米囊泡。因此,生物医学领域中一大关注点在于理解外泌体大小的分泌囊泡的生物发生过程。人们普遍认为,外泌体蛋白通过一个多步骤、依赖于内吞作用的途径从细胞中发芽,包括将外泌体标记蛋白传递到内体、将这些蛋白负载到新生的胞内腔囊泡(ILVs)中,以及当含有ILV的内体(也称为多囊泡体)与质膜融合时释放ILV为外泌体。这一模型还扩展到包括CD63和核心蛋白作为syntenin的招募因子,syndecan-syntenin和CD63-syntenin复合物作为蛋白Alix的招募因子,以及Alix在招募ESCRT(细胞内分泌物质转运复合物)机器到内体膜上驱动ILV形成中的作用。这一模型基于已确立的蛋白质相互作用,并且与当前ESCRT促进向外囊泡发芽(向外=远离细胞质)和一般膜封闭的模型一致。鉴于通过研究其最丰富的蛋白质已阐明了其他细胞器生物发生途径,研究人员通过研究最丰富的外泌体蛋白来研究外泌体的生物发生。在最近对24种人类外泌体标记蛋白的并行比较中,研究人员发现外泌体四次跨膜蛋白CD81、CD9和CD63在外泌体大小的EVs中比其他21种测试的标记蛋白更丰富,比如syntenin、Alix和ESCRT蛋白TSG101。这一结果在几个层面上是合理的,第一CD81、CD9和CD63是第一批被证明富集在外泌体中的蛋白质,第二是CD81、CD9和CD63几十年来一直被用作外泌体标记蛋白。然而,研究人员对CD81、CD9和CD63的运输和囊泡分泌的初步研究并不支持当前外泌体生物发生的主流模式。具体来说,研究人员发现CD81和CD9存在于质膜上,并且从细胞中发芽的效率分别比CD63高15倍和5倍,而CD63则是从质膜上不断地进行内吞,存在于内吞体内。此外,研究人员发现将内吞信号附加到CD9上会阻止CD9从细胞中出芽,而突变掉CD63的内吞信号则会诱导其从细胞中出芽。简而言之,这些观察结果表明,当前的外泌体生物发生模式与细胞实际上如何从细胞中出芽外泌体标记蛋白存在很大差距。为进一步探究这一空白,研究人员研究了内吞信号、内吞抑制剂以及它们的表达水平对CD81、CD9和CD63的囊泡分泌的影响。研究结果表明,内吞作用强烈抑制了所有这些高度丰富的外泌体标记蛋白的外泌体分泌,并且在CD81和CD9存在的情况下触发了它们的破坏。研究人员还展示了六种机制上不同的内吞抑制剂都诱导了CD63的囊泡分泌,而CD63具有内吞信号,但对不具有内吞信号的CD81的囊泡分泌没有影响。最后,研究人员表明CD63的高水平表达直接结合了clathrin适配蛋白AP-2亚单位mu2,抑制了内吞作用,诱导了质膜积累和溶酶体蛋白的囊泡分泌,并触发了AP-2亚单位mu2的囊泡分泌和细胞耗竭。这些和其他结果支持了外泌体标记蛋白从细胞上以质膜和内体膜的途径分裂出来,主要通过一种独立于内吞作用的途径。参考文献:Endocytosis blocks the vesicular secretion of exosome marker proteins. Sci Adv. 2024 May 10;10(19):eadi9156.外泌体资讯网 Sci Adv丨内吞作用阻止外泌体标记蛋白的囊泡分泌





