外膜囊泡(OMVs)是由革兰氏阴性菌在培养或感染过程中产生的纳米尺寸球形蛋白脂质体。革兰氏阴性菌有两层膜,内膜(IM)和外膜(OM),它们之间有肽聚糖(PG)网络和周质空间。OM的小突起可以夹断并成为细胞外小泡,PG结构的改变可以影响脂蛋白附着,减少IM和OM之间的交联,间接增加OMVs的形成。裂解酶是噬菌体编码的肽聚糖水解酶,由于从外部应用重组裂解酶可以水解细胞膜的PG层并杀死细菌,裂解酶和细菌之间的相互作用可能会破坏细胞膜的稳定,导致OMVs的产生。
中国科学院武汉病毒研究所危宏平研究员团队在Journal of Nanobiotechnology杂志上发表题为“Outer membrane vesicles generated by an exogenous bacteriophage lysin and protection against Acinetobacter baumannii infection”的论文( 2024 May 21;22(1):273),主要介绍了一种使用高活性鲍曼不动杆菌噬菌体裂解酶LysP53刺激OMVs产生的新方法。与自然分泌的OMVs相比,裂解酶诱导的OMVs表现出更好的同质性、更高的蛋白质产量、更低的内毒素含量和更低的细胞毒性。在小鼠模型中,裂解酶诱导的OMVs能够有效预防鲍曼不动杆菌的感染。论文第一作者为李唱唱博士后,通讯作者为危宏平研究员。
由于OMVs由细菌衍生的抗原和能够调节免疫系统的多种病原体相关分子模式(PAMPs)组成,它们在生物技术方面具有十分重要的应用潜力,特别是在疫苗开发方面。为了探索裂解酶产生OMVs的可行性,作者团队使用对于革兰氏阴性菌(特别是鲍曼不动杆菌)具有高效裂解活性的的裂解酶LysP53,来验证这一假设。结果表明,鲍曼不动杆菌、大肠杆菌和沙门氏菌的细菌细胞都可以被LysP53刺激产生OMVs,裂解酶LysP53处理后的鲍曼不动杆菌细胞分泌的细胞外小泡显著增加。更重要的是,与自然分泌的OMVs相比,裂解酶诱导的OMVs表现出更好的均一性、更高的蛋白质产量、更低的内毒素含量和更低的细胞毒性。
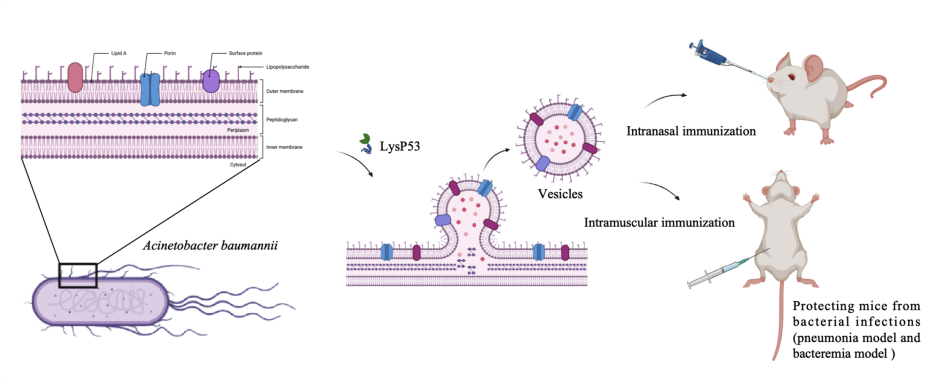
在这项研究中,作者团队还建立了鲍曼不动杆菌感染的肺炎和菌血症小鼠模型进一步评估了裂解酶诱导的OMVs作为细菌疫苗的保护潜力。用裂解酶诱导的OMVs进行三次肌内免疫能够对鲍曼不动杆菌感染提供100%的保护,而鼻内免疫在肺炎模型中可以提供良好的防护,但在菌血症模型中保护较弱。这种保护作用可能是由于OMVs能诱导体液和细胞免疫反应。此外,免疫血清对鲍曼不动杆菌感染后的治疗也显示出一定的效果。总之,与目前的OMVs生产方法相比,这种新型裂解酶产生OMVs方法提供了一种有前景的选择,尤其是在耐药细菌疫苗研发方面。
参考文献:
Li C, Xue H, Du X, Nyaruaba R, Yang H, Wei H. Outer membrane vesicles generated by an exogenous bacteriophage lysin and protection against Acinetobacter baumannii infection. J Nanobiotechnology. 2024 May 21;22(1):273.
外泌体资讯网 J Nanobiotechnol|中国科学院武汉病毒研究所危宏平:外源性噬菌体裂解酶产生的外膜囊泡对鲍曼不动杆菌感染的保护作用





