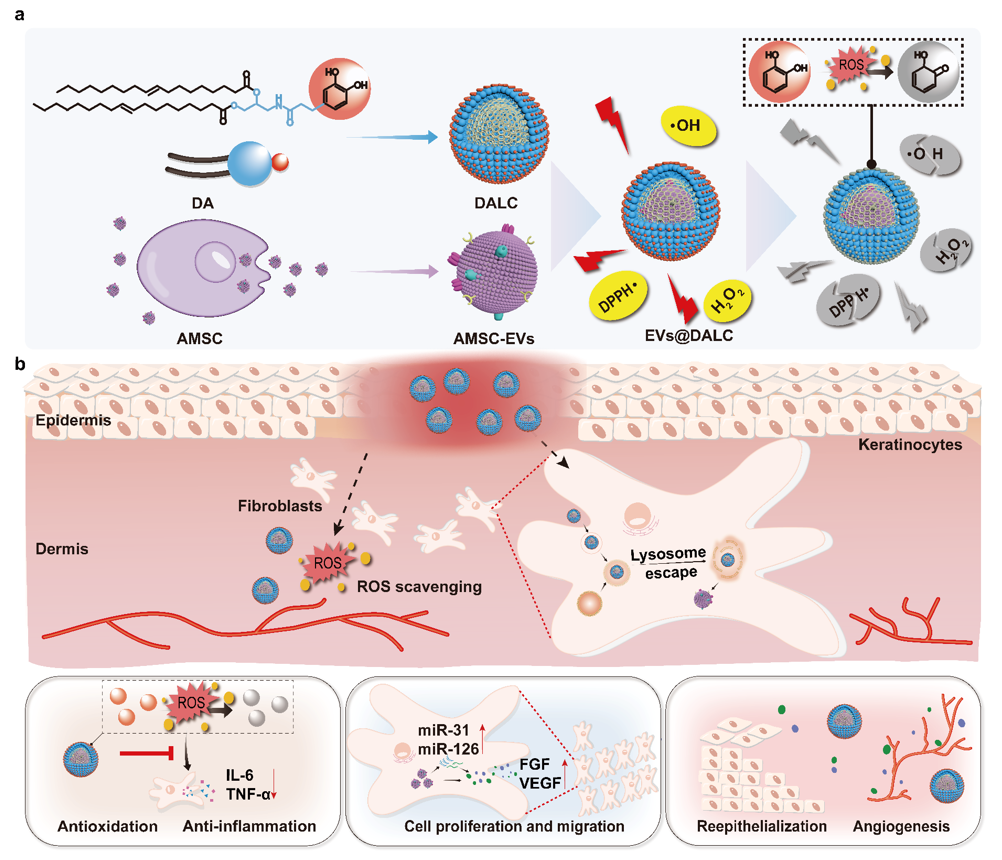
创伤、手术以及急性或慢性疾病后的伤口愈合不良影响全球数百万人。由于炎症、增殖和基质重塑的动态和复杂的病理特征,伤口管理一直是临床治疗中的重要挑战。为了应对这一挑战,对多阶段病理微环境的调节和管理可能为伤口愈合提供一种可行的方法。中国科学院上海药物研究所张馨欣研究团队合成了一种具有活性氧(ROS)清除作用的新型脂质材料(DA),以制备DA脂质液晶(DALC),并将DALC与脂肪间充质干细胞来源的细胞外囊泡(AMSC-EVs)复合,制备了一种新型的支架敷料(EVs@DALC)用于伤口治疗。DALC不仅赋予EVs@DALC以ROS清除位点,以缓解创伤部位微环境中的氧化应激和炎症反应,而且还有利于AMSC-EVs中包含的microRNA和生长因子的细胞摄取和转染。得益于DALC,AMSC-EVs有效地将microRNA和生长因子转移到皮肤细胞中,诱导细胞增殖和迁移,加速血管生成。该研究提供了一种基于抗氧化脂质液晶递送细胞外囊泡治疗皮肤创伤的有效策略,并且有利于推进干细胞细胞外囊泡的临床转化。相关内容以“ROS-scavenging lipid-based liquid crystalline as a favorable stem cell extracellular vesicles delivery vector to promote wound healing”为题于6月3日的Journal of Controlled Release杂志上在线发表(2024 Jun 3:371:298-312)。
创伤、手术以及急性或慢性疾病后的伤口愈合不良影响全球数百万人。研究表明,多个调控轴和生物物理信号级联在影响组织修复过程中起着关键作用。在炎症阶段,活性氧(ROS)的过量产生会增强许多炎症细胞分泌的各种促炎症因子的表达。同时,为了进一步加速皮肤再生,需要生物活性因子如生长因子来促进血管生成、重新上皮化和细胞外基质的重塑。对皮肤愈合机制更深入的理解引发人们对外源生物分子在伤口愈合过程中的作用兴趣增加,由此促进了生长因子、细胞疗法及基因疗法等多种策略被开发用于伤口愈合管理。近年来研究发现,干细胞细胞外囊泡(EVs)在创伤修复中有着重要的作用,携带生长因子和microRNA的干细胞EVs可以促进细胞的迁移,提高细胞的存活率,促进细胞再生,以改善创伤的愈合速度。然而,EVs在体内的半衰期较短,难以维持其生物活性。尽管已经开发了如水凝胶、胶原蛋白和角蛋白海绵等生物活性支架来包载EVs,以延长其在皮肤上的停留时间,维持EVs的活性并加速伤口愈合速度,但是支架生物材料无法有效穿透人类皮肤的物理屏障,使得材料难以将EVs带入细胞中,导致由EVs携带的miRNA的转染效率低下。因此,应设计一种与皮肤在生理化学上具有更高相似性的递送系统,以最大化干细胞衍生细胞外囊泡在伤口管理中的效果。脂基液晶(LLC)已成为一种很有前景的递送系统。得益于脂质分子的两亲性,LLC已证明了递送多种疏水、亲水和两亲性治疗成分的能力。需要注意的是,角质层的渗透性屏障主要由神经酰胺、胆固醇和游离脂肪酸等饱和脂质形成。角质层的存在限制了小的亲脂性药物的扩散。LLC可以克服皮肤角质层的生理屏障,提高药物的溶解度和皮肤通透性。此外,由于LLC具有合适的黏度和黏附性,具有将药物带入细胞内的潜力。在这项研究中,研究人员设计了一种基于抗氧化脂质材料的脂质液晶,递送干细胞EVs(EVs@DALC),从而在伤口愈合的多个阶段发挥综合治疗效果。将3,4 -二羟基苯丙酸与二油硬脂素-3-氨基-1,2-丙二醇连接合成新型脂质材料(DA),并用于制备基于抗氧化脂质材料的脂质液晶(DALC)。成功制备DALC并分AMSC-EVs,将DALC与AMSC-EVs共孵育制备EVs@DALC。DALC能够清除创面部位过量的ROS,发挥抗炎作用。同时,得益于DALC良好的递送特性,EVs@DALC有望增强细胞摄取和溶酶体逃逸,从而可能促进EVs携带的miRNA的转染,从而促进皮肤细胞的增殖和迁移。本文系统研究了抗氧化剂DALC的ROS清除和抗炎特性,细胞摄取和miRNA转染特性,伤口愈合效果,体内外评估结果显示,DALC具有清除多种自由基(DPPH•,•OH,H2O2)功能,有助于改善炎症反应(降低TNF-α和IL-6的表达)。同时,DALC的亲脂性和正电荷特性促进了AMSC-EVs通过表皮层的转运,增强了细胞摄取能力,进一步有利于miRNA(miR-31,miR-126)的转染和生长因子(FGF,VEGF)的表达。DALC联合AMSC-EVs具有强大的多阶段病理调控能力,包括干预炎症、增殖和基质重塑。新型载体DALC可以用于EVs、细胞和基因递送,具有治疗各种以炎症环境为特征的疾病的潜力。图1 示意图(a)EVs@DALC的合成过程和(b)EVs@DALC在伤口部位的治疗效果ROS-scavenging lipid-based liquid crystalline as a favorable stem cell extracellular vesicles delivery vector to promote wound healing, Journal of Controlled Release. 371 (2024) 298-312.外泌体资讯网 J Control Release|中国科学院上海药物研究所张馨欣研究团队:清除ROS的脂质液晶递送载体促进伤口愈合