外泌体是细胞外囊泡(extracellular vesicles,EVs)中的一类,是细胞在静息或应激状态下释放到胞外的脂质双层膜囊泡。外泌体的组成物质十分丰富,其生物学功能具有多样性。外泌体通过多种复杂的机制实现其抗炎作用,包括分泌抗炎蛋白质和细胞因子、调控基因表达、影响免疫细胞功能以及清除细胞垃圾和减轻氧化应激等。外泌体还能够调节免疫细胞的分化和功能,例如促进抗炎性T细胞的生成,抑制炎症性T细胞(如Th17细胞)的分化,从而平衡免疫应答,减轻过度的炎症反应。除此之外,外泌体的运载功能也是学者研究的热点。作为内源性细胞小室,外泌体具有广泛的细胞粘附分子,有助于它们穿透生物屏障。工程化外泌体多是借助于基因工程或化学修饰手段改造天然外泌体而形成。这些改造措施可以针对性地的解决天然外泌体带来的副作用,优化其生物活性、稳定性以及靶向性,进一步提升其特异性和递载功能,更好的作用于疾病治疗,有广阔的发展前景。相比于天然外泌体,工程化外泌体的免疫原性低,毒副作用小,有更好的组织靶向性,在多种自身免疫性疾病中有广阔的应用前景。
近期,山西医科大学第三临床医学院许珂教授团队在International Journal of Nanomedicine杂志上发表题为“Innovative Diagnosis and Therapeutic Modalities: Engineered Exosomes in Autoimmune Disease”的综述(2024 May 1:19:3943-3956)。山西医科大学硕士研究生季雨立、博士研究生米良煜为论文的共同第一作者,许珂教授为该论文的通讯作者。
该综述对目前外泌体主要的工程化修饰改造以及药物递载进行了详细介绍,重点对将工程化外泌体在几种典型自身免疫性疾病,例如类风湿关节炎、系统性红斑狼疮、干燥综合征、血管炎、自身免疫性肝病等疾病中的应用进行了总结,并概述了其在临床应用中的前景。该研究工作获得了山西省自然科学基金面上项目以及山西省基础研究计划项目的支持。
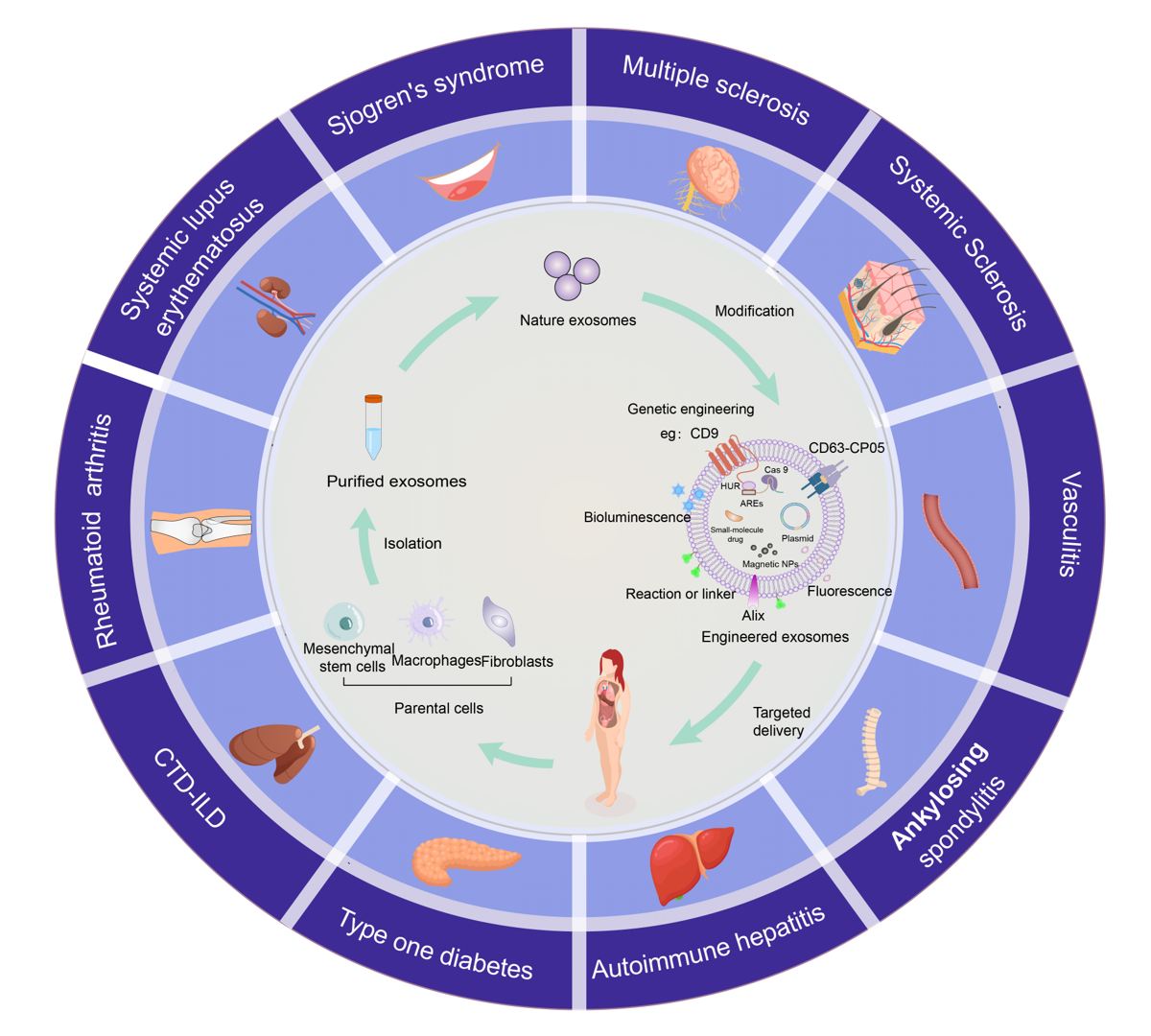
当前有关工程化外泌体的研究一方面多聚焦在天然外泌体的低免疫原性基础上,专项修饰某些miRNA,转运并减少其降解,从而促进miRNA转录后表达并调控相应靶蛋白的表达。通过调控各种靶蛋白进而调节各种信号通路,进一步缓解自身免疫病的病情进展。另一方面则是探索如何充分利用工程化外泌体的运载功能,有效提高现有药物的治疗效果。未来学者应继续探究工程化外泌体的运输靶向性、循环稳定性和生物相容性等特性在自身免疫病相关治疗中的潜在价值,推动工程化外泌体临床阶段的使用发展,促使外泌体能在自身免疫病中充分展示其价值。参考文献:Innovative Diagnosis and Therapeutic Modalities: Engineered Exosomes in Autoimmune Disease. Int J Nanomedicine. 2024 May 1; 19:3943-3956. doi : 10.2147/IJN.S452184.
外泌体资讯网 Int J Nanomedicine|山西医科大学第三临床医学院许珂团队:创新性诊断与治疗方式:自身免疫性疾病中的工程化外泌体





