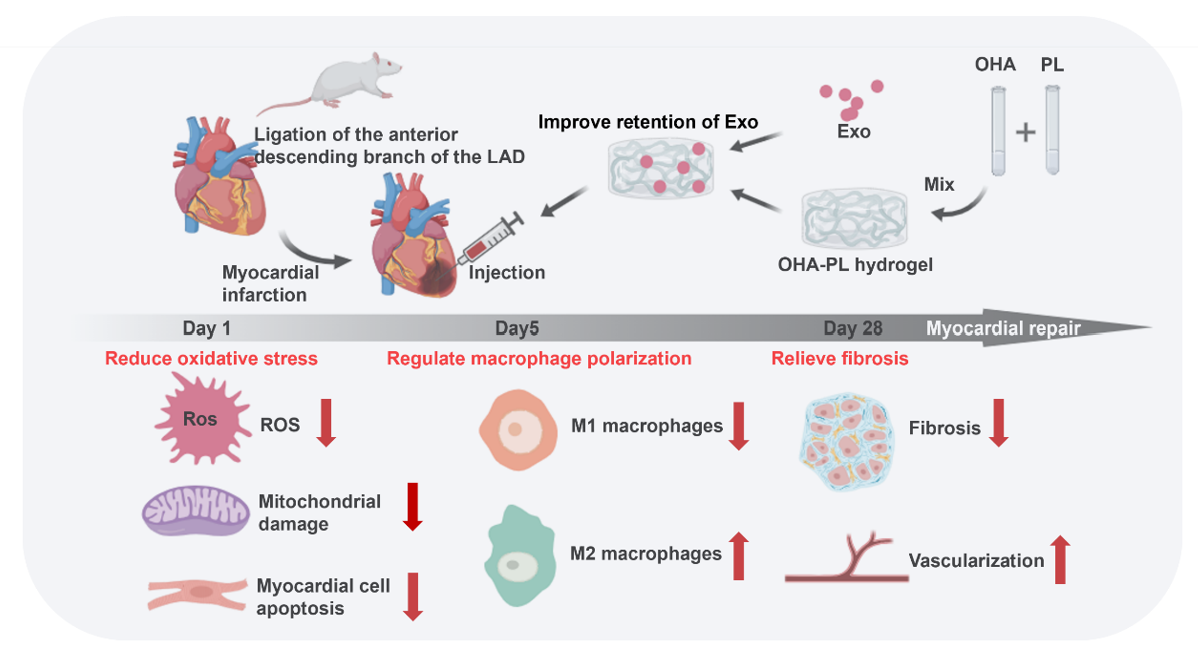
心血管疾病是世界上发病率最高的疾病之一。心肌梗死(myocardial infarction,MI),尤其是急性心肌梗死,是最常见的疾病。冠状动脉长期缺血缺氧会导致心肌坏死,可引起心律失常、动脉瘤、心脏破裂等并发症,最终导致心力衰竭,严重威胁人类健康。研究表明,脂肪间充质干细胞(Adipose mesenchymal stem cells,ADSCs)在损伤后的组织修复中发挥着至关重要的作用,来源于ADSCs的外泌体(Exosomes,Exos)可复制其亲代细胞的抗炎、抗凋亡、促血管生成和抗纤维化作用,从而改善心脏功能。虽然Exos对缺血性心脏病有一定的治疗效果,但由于其稳定性低、停留时间短,因此在组织修复方面的应用仍受到限制。研究表明,心肌注射3 h后就无法检测到Exos,这一问题可以通过水凝胶和其他生物材料来解决。近日,华北理工大学孙红、车鹏程教授团队与天津大学李俊杰教授团队研发了一种具有生物相容性和生物降解性的氧化透明质酸-聚赖氨酸(Oxidized hyaluronic acid-polylysine,OHA-PL)水凝胶,可有效提高Exos滞留率并加强Exos的治疗效果。相关内容以“An injectable exosome-loaded hyaluronic acid-polylysine hydrogel for cardiac repair via modulating oxidative stress and the inflammatory microenvironment“为题发表在International Journal of Biological Macromolecules杂志上(2024 Jul 3:133622)。文章第一作者为华北理工大学硕士研究生任宇晨,通讯作者为华北理工大学孙红教授。
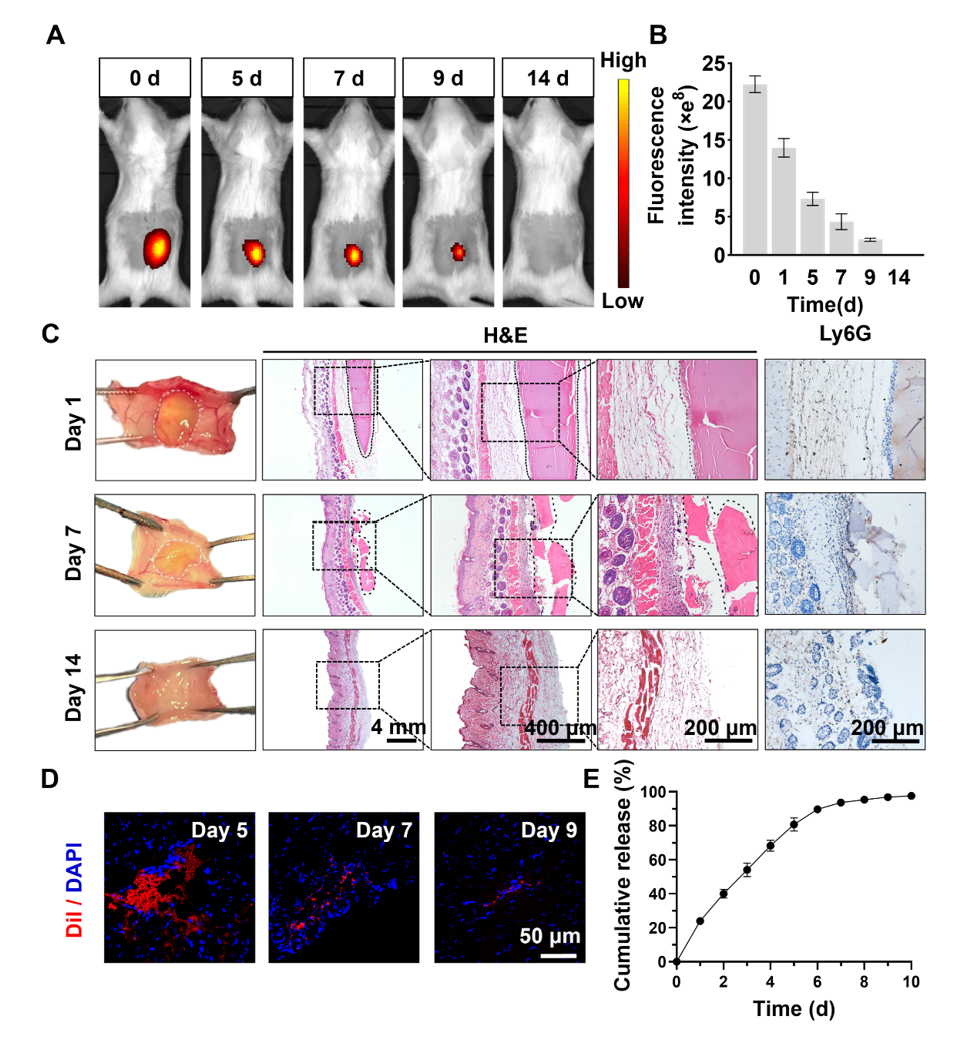
在这项工作用,作者使用大鼠MI模型来验证实验的可行性,并详细研究了OHA-PL水凝胶负载Exos在清除活性氧(Reactive oxygen species,ROS)、调节巨噬细胞化、减轻炎症反应、减轻心肌纤维化和心室重构以及促进血管生成方面的作用。小动物活体成像证实OHA-PL水凝胶在体内的具有良好的降解性,且免疫组化染色观察Ly6G中性粒细胞的积聚很少,说明在体内没有明显的炎症反应。为了追踪Exos在体内的分布,用Dil标记Exos。荧光图像显示,心肌内注射OHA-PL@Exo水凝胶后5 d,在心肌组织中观察到大量红色荧光。7 d,荧光强度下降。9 d,荧光信号几乎不可见。将Exos包埋进OHA-PL水凝胶中并研究其在PBS中的释放情况,可以观察到Exos从OHA-PL水凝胶中逐渐释放出来。最初是爆发性释放,随后是持续性释放。说明将Exos添加到OHA-PL水凝胶中可实现长期持续释放。心肌细胞损伤导致了ROS积累、线粒体损伤和严重的细胞凋亡。OHA-PL水凝胶能够持续释放Exos,减轻MI区域早期的氧化应激损伤。冠状动脉闭塞导致MI,随之而来的是心肌血流量减少。长期缺血缺氧会导致大量心肌细胞死亡,并出现心肌纤维化。OHA-PL@Exos水凝胶治疗MI不仅能显著减少梗死区胶原的沉积,还能减少邻近区胶原的沉积,这表明含有Exos的OHA-PL水凝胶具有更全面的抗纤维化作用。An injectable exosome-loaded hyaluronic acid-polylysine hydrogel for cardiac repair via modulating oxidative stress and the inflammatory microenvironment, Int J Biol Macromol. 2024 Jul 3:133622. doi: 10.1016/j.ijbiomac.2024.133622.外泌体资讯网 Int J Biol Macromol|华北理工大学孙红/车鹏程/天津大学李俊杰:一种可注射外泌体透明质酸聚赖氨酸水凝胶修复心脏