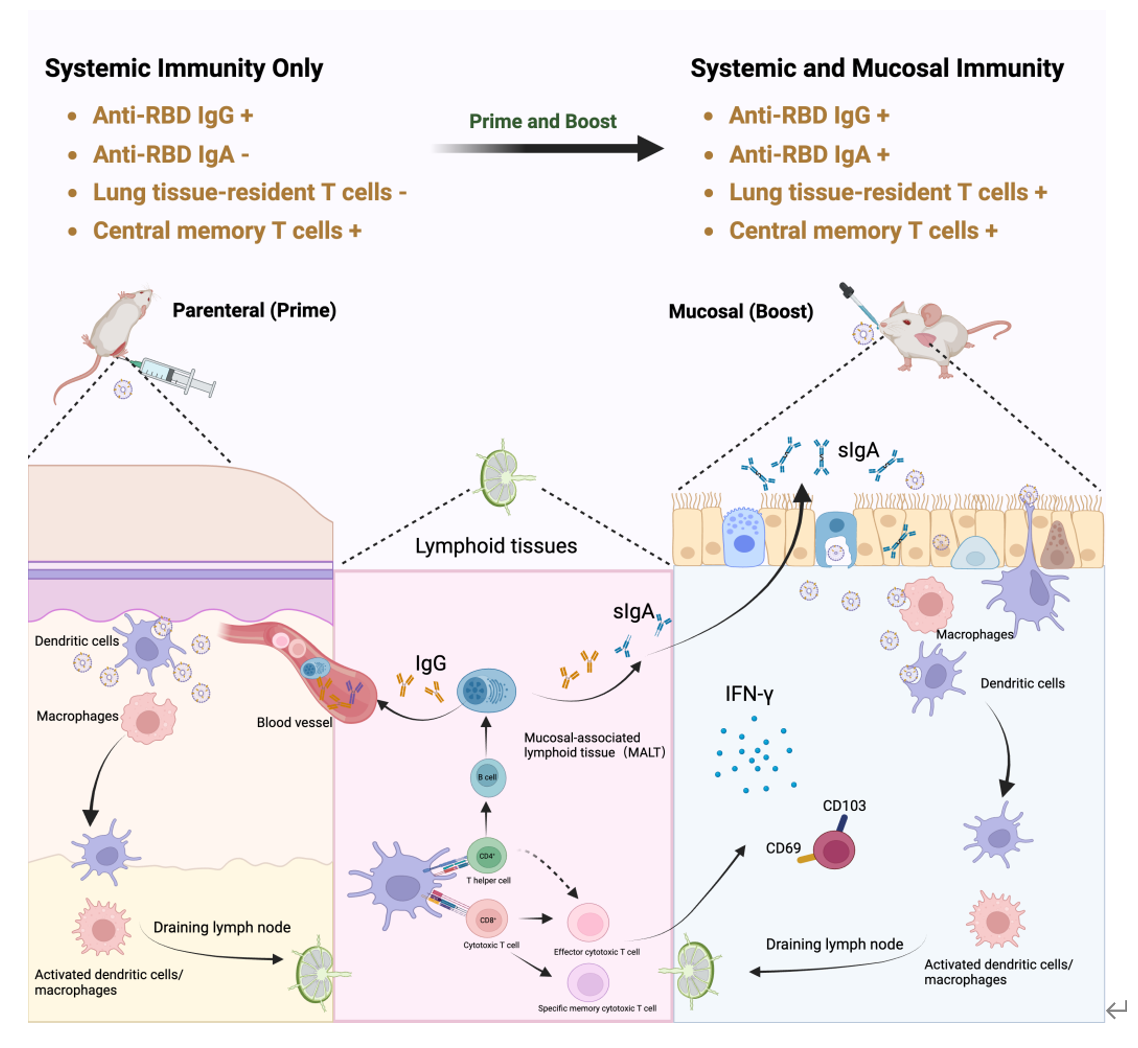
新型冠状病毒疫情(COVID-19)爆发以来,人类为对抗病毒做出了巨大努力,研发的疫苗成功降低了重症和死亡率,然而却无法遏制病毒传播且对变异株的保护效果不佳。新冠病毒(SARS-CoV-2)表现出免疫学逃逸和解剖逃逸特性。随着变异株的持续出现,这些变异不仅能够逃避由先前的自然感染或疫苗接种产生的保护性抗体,而且由于人类呼吸道中的抗体水平远低于外周血液中的抗体水平,导致病毒能在其初始部位感染和复制——呼吸道黏膜上实现解剖学上的逃逸。面对新型冠状病毒时的无力感,无时无刻不在提醒着我们还需要更多理论、技术上的积累和突破,在未来再次面对病毒挑战时,能更好的保护人民的生命安全。近日,军事医学研究院郑爱萍教授团队团队在ACS Nano杂志上发表题为“Virus-Mimetic Extracellular-Vesicle Vaccine Boosts Systemic and Mucosal Immunity via Immune Recruitment”的论文,主要介绍了一种仿生细胞外囊泡疫苗。该疫苗展示出了良好的自佐剂效应,通过模拟天然病毒的形态、大小以及免疫原性,能够有效地激活免疫系统,产生黏膜保护效果。军事医学研究院郑爱萍教授、邢昊楠博后、首都医科大学崔纯莹教授为共同通讯作者,博士研究生李静如为该文章第一作者。
在这项研究中,作者通过基因工程技术将SARS-CoV-2的RBD抗原蛋白表达于树突状细胞细胞(DC)的表面,并通过低功率间歇超声处理的方式诱导细胞产生大量的细胞膜囊泡(EV-RBD)。纳米粒子示踪分析及透射电镜显示,EV-RBD的大小约为140~150 nm,呈现病毒拟态。稳定性研究结果显示,EV-RBD在不同温度下表现出良好的物理结构和抗原稳定性,纳米囊泡载体良好的脂质环境和结构稳定性,为抗原的稳定保留和有效递送提供了保证。EV-RBD纳米级大小以及颗粒化抗原使它们能够被免疫细胞快速识别。此外,DC衍生的细胞外囊泡的淋巴归巢效应,使得EV-RBD疫苗能够在淋巴系统中快速富集并激发免疫反应。该疫苗经肌注或黏膜免疫接种后,均可迅速招募抗原呈递细胞(APCs),增强免疫系统对抗原的识别和响应,高效引发固有免疫应答。此外,疫苗诱导适应性免疫应答,通过肌注初免与黏膜加强的免疫方式,产生了高水平的抗原特异性分泌型IgA抗体(sIgA)和组织驻留记忆T细胞(TRM),显著增强了局部黏膜免疫反应,从而形成了针对呼吸道病原体的局部免疫保护效应。Virus-Mimetic Extracellular-Vesicle Vaccine Boosts Systemic and Mucosal Immunity via Immune Recruitment.ACS Nano. doi: 10.1021/acsnano.4c01277外泌体资讯网 ACS Nano|军事医学研究院郑爱萍教授团队:仿生病毒的细胞外囊泡疫苗通过免疫招募增强系统和黏膜免疫反应