新生儿先天性肺发育不全是由先天性膈疝(CDH)等原因造成。在CDH模型中,羊水干细胞外泌体(AFSC-EVs)的产前给药逆转了肺发育不全的特征。然而,AFSC-EV治疗影响了胎儿肺的哪些细胞组分和生物途径尚不清楚。来自加拿大多伦多病童医院的研究人员使用单核RNA测序(snRNA-seq),揭示了CDH胎儿肺中失调的基因和生物途径,并确定产前AFSC-EV治疗对胎儿肺细胞群体的影响和潜在治疗价值。相关内容以“Fetal hypoplastic lungs have multilineage inflammation that is reversed by amniotic fluid stem cell extracellular vesicle treatment”为题发表于7月26日的国际知名综合性学术期刊Science Advances杂志上。
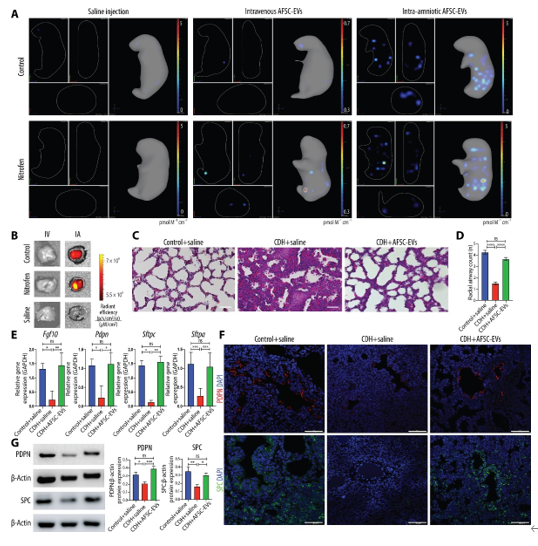
先天性肺发育不全的特征在于胎儿肺部发育受损。其中一种常见原因是新生儿先天性膈疝(CDH),即膈肌未完全闭合,导致腹部器官疝入胸腔。肺发育不全表现为生长障碍(支气管和肺泡减少)、成熟障碍(上皮和间质未成熟)、以及血管化障碍(肺血管减少、血管壁层肌化不足和内皮功能失调)。肺发育不全的严重程度与CDH引起的肺动脉高压及室壁功能障碍相关,是影响患者发病率和死亡率的主要因素(在高收入国家的死亡率为20%到30%;而在低收入和中等收入国家为超过90%)。由于严重的肺发育不全,一些胎儿会在子宫内死亡或选择性终止妊娠,一些在出生后的头几天内死亡,而许多幸存着接受了手术治疗后,无法恢复正常的肺发育并长期患有肺部疾病。有共识认为,产前是逆转肺发育不全的机会窗口,并已有研究尝试促进胎儿肺部的产前发育。研究团队先前的研究显示,羊水干细胞外泌体(AFSC-EVs)的给药促进了支气管形态发生,恢复了组织稳态,并刺激了胎儿小鼠肺部发育不全模型中上皮细胞和成纤维细胞的分化。外泌体是一种含有小RNA、蛋白质和脂质等载体的脂质结合纳米颗粒,可以将这些载体转运到靶细胞中,诱导生物学反应。研究团队观察到,羊水干细胞外泌体(AFSC-EVs)不仅在假腺期,还在管状和囊泡期的肺部发育阶段能够促进肺细胞分化和恢复失调的信号通路,这些时间点对人类的转化具有可行性。酶学和抑制研究证明,AFSC-EV治疗后观察到的在肺发育不全中的再生效果,至少部分是通过它们的RNA载体实现的。AFSC-EV的RNA测序显示,其载体货物含有多种生物分子,包括调控肺部发育相关基因表达的microRNA(miRNA),如miRNA 17~92簇。这与肺部发育过程部分由多种miRNA调控相关,这些miRNA在实验性和人类CDH肺中的表达缺失或失调。最近,研究团队还证明产前给予AFSC-EVs能改善胎儿的生存率和机械通气参数,如顺应性和阻力。目前尚不清楚AFSC-EVs影响哪些肺细胞以及它们如何恢复肺部发育所需的生物途径。因此,在本研究中,研究人员在分别用对照溶剂或AFSC-EVs处理的受CDH影响的大鼠胎儿肺中进行了单核RNA测序(snRNA-seq)。结果发现,经羊水内注射的AFSC-EVs可到达CDH大鼠胎儿肺,促进肺支气管形态发生和上皮细胞分化。此外,snRNA-seq揭示了CDH大鼠胎儿肺具有多系炎症特征,以富集的巨噬细胞为主,而这些特征在AFSC-EV治疗后得以逆转。通过免疫荧光、流式细胞术和GW2580抑制研究,研究人员验证了CDH胎儿大鼠肺中巨噬细胞的富集。此外,研究人员还验证了人类CDH胎儿肺尸检样本中的巨噬细胞富集情况。综上所述,本研究推动了肺发育不全病理机制的认识,并进一步证明了基于EV的治疗在CDH胎儿中的价值。参考文献:Fetal hypoplastic lungs have multilineage inflammation that is reversed by amniotic fluid stem cell extracellular vesicle treatment. Sci Adv. 2024 Jul 26;10(30):eadn5405.




