外泌体作为组织修复和再生的有前景的治疗手段,通过诱导适当的免疫反应来治疗营养不良病理。然而,操控外泌体以控制其生物分布并在体内靶向实现足够的治疗效果仍是一个重大挑战。近日,Nature Nanotechnology杂志上发表一篇文章,通过开发一个外部可控的递送系统来克服这一限制,该系统用于经预处理的AnxA1肌外泌体(Exomyo)。通过将Exomyo固定在铁磁纳米管上,实现了控制Exomyo的递送和定位到骨骼肌。在Duchenne型肌营养不良的小鼠模型中协同促进有益的肌肉反应。 炎症的及时解决对于在感染或损伤后恢复肌肉稳态,并避免包括肌营养不良在内的慢性炎症病理是必要的。巨噬细胞在这一过程中起着关键作用,因为它们能够从通常的促炎状态转变为抗炎表型。工程化外泌体是<200纳米的细胞外囊泡,能够携带多种信号生物分子,包括免疫介质,如AnxA1(Annexin A1),后者已成为巨噬细胞极化的关键调节因子。先前关于外泌体递送用于治疗不同形式的肌营养不良的研究结果令人鼓舞,表明精确操控外泌体可以促进病理过程中的组织修复。
炎症的及时解决对于在感染或损伤后恢复肌肉稳态,并避免包括肌营养不良在内的慢性炎症病理是必要的。巨噬细胞在这一过程中起着关键作用,因为它们能够从通常的促炎状态转变为抗炎表型。工程化外泌体是<200纳米的细胞外囊泡,能够携带多种信号生物分子,包括免疫介质,如AnxA1(Annexin A1),后者已成为巨噬细胞极化的关键调节因子。先前关于外泌体递送用于治疗不同形式的肌营养不良的研究结果令人鼓舞,表明精确操控外泌体可以促进病理过程中的组织修复。
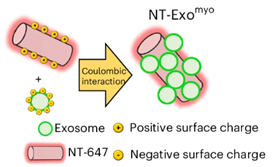
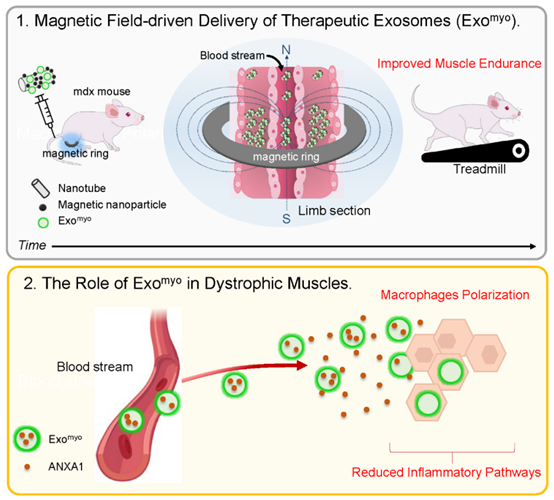
来源于肌源性细胞的外泌体可以在肌营养不良、肌肉衰减和恶病质的动物模型中引起功能改善并减轻肌肉消耗。相比之下,内源性分泌的外泌体在DMD(杜氏肌营养不良症)中可能具有保护作用或促进病理传播。按照MISEV2018指南从C2C12细胞培养基中收集了外泌体(ExoC2C12)。纳米颗粒追踪分析(NTA)和透射电子显微镜(TEM)显示,ExoC2C12中存在杯状囊泡,这是外泌体的特征。Western blotting确认了与外泌体四跨膜蛋白和外泌体形成相关的蛋白标志物的表达。非外泌体标志物的缺失排除了潜在的污染物或非外泌体成分。CFSE染色的ExoC2C12通过随机光学重建显微镜(dSTORM)和Amnis成像流式细胞术得到了确认。液相色谱-串联质谱(LC-MS/MS)分析ExoC2C12显示了属于基因本体(GO)通路的蛋白质,这些通路与细胞增殖和运动、骨骼肌细胞分化、能量稳态以及炎症和抗炎过程相关。ANXA1在促进炎症状态的解决、中性粒细胞凋亡和重新编程巨噬细胞向具有增强凋亡细胞吞噬能力的抗炎表型方面起到了主要作用。使用细胞骨架扰动剂细胞松弛素D对C2C12细胞进行体外预处理。随着细胞松弛素D浓度的增加,ANXA1的表达呈线性增加。蛋白质组学分析确认了使用100 μM细胞松弛素D时外泌体ANXA1的表达增加。为了研究Exomyo在营养不良肌肉细胞中的肌源性命运决策中的作用,从3个月大的mdx小鼠的后肢中分离出卫星细胞(SCs)并诱导其分化成肌管。与ExoC2C12或单独培养基相比,Exomyo促进了长度和宽度更大的肌管的发育。这表明Exomyo参与了肌源性分化的后期阶段。同时,从3个月大的mdx小鼠的肌肉中新鲜分离出来的巨噬细胞在存在108个Exomyo或108个ExoC2C12的条件下培养5天。未经处理的巨噬细胞表达了高水平的经典炎症M1基因。相比之下,与处理108个ExoC2C12的巨噬细胞相比,处理Exomyo的巨噬细胞表现出更高的抗炎M2相关基因的表达以及M1基因的下调。这些发现提供了Exomyo诱导M2巨噬细胞极化的有力证据。然而,全身生物分布具有挑战性,因为外泌体的组成,特别是脂质和蛋白质含量,会影响药代动力学和生物利用度。解决这一问题的潜在方法是使用可以通过外部刺激控制的外泌体载体,以实现精确的靶向和递送,从而按需操控治疗性外泌体的生物分布。用于将连接的染料Alexa Fluor 647附着到装饰有CFSE+ Exomyo的纳米管(NTs)的表面自组装机制示意图。该研究提出使用铁磁纳米管(NT-MAGs)进行磁场控制的外泌体递送和体内定位。通过利用库仑相互作用,NT-MAGs与表面固定的AnxA1肌外泌体(Exomyo)结合。研究证明,NT-MAGs可以有效地结合和运输Exomyo,并且在系统注射后,在外部磁场的作用下,在Duchenne型肌营养不良(DMD)的鼠模型mdx小鼠的指定肌肉中积累。这种控制递送最大化了Exomyo在营养不良肌肉中的生物功能,改善了肌肉功能。为了研究在mdx小鼠中肌肉性能的改善是否可以特定归因于由磁场驱动的Exomyo在肌肉中的积累,作者比较了每周静脉注射NT-MAG-Exomyo(NT-MAG-ExomyoIII,三次注射)和对磁场不响应的NT-Exomyo(NT-ExomyoIII,三次注射)在3个月大mdx小鼠中的效果。与NT-Exomyo III mdx小鼠相比,NT-MAG-ExomyoIII mdx小鼠表现出肌肉疲劳减少和耐力改善,而NT-Exomyo III mdx小鼠的疲劳模式与载体处理的mdx组相当。与载体处理和NT-ExoMyo III mdx小鼠相比,NT-MAG-ExomyoIII mdx小鼠的胫前肌(TA)中Ly6C+浸润巨噬细胞的数量减少。NT-MAG-Exomyo III mdx小鼠中M1 CD68+CD206-巨噬细胞数量显著减少,同时伴随着M2 CD68+CD206+巨噬细胞数量的增加,这表明NT-MAG-Exomyo促进了M2极化,暗示了潜在的免疫调节作用。对NT-MAG-ExomyoIII mdx小鼠TA肌肉的组织学分析显示,与载体处理和NT-ExomyoIII mdx小鼠相比,肌肉退化显著减少,表现为退化纤维(IgG+)数量减少和健康的边缘核纤维和再生的eMHC+纤维百分比增加。此外,与载体处理和NT-ExomyoIII mdx小鼠相比,NT-MAG-Exomyo III mdx小鼠的TA肌肉纤维尺寸显著增加,表明肌肉中发生了代谢重编程。相应地,NT-MAG-ExomyoIII mdx小鼠的TA中SDH+肌纤维数量增加。与载体处理和NT-Exomyo III mdx小鼠相比,NT-MAG-ExomyoIII mdx小鼠的TA中羟脯氨酸显著减少,确认了纤维化的减少。治疗性外泌体控制递送策略的示图。磁场敏感的纳米载体由具有生物相容性的纳米管和装饰着铁磁纳米颗粒组成,通过血管运输外泌体,通过外部磁场的应用将其定位到骨骼肌,从而有助于缓解杜氏肌营养不良症(DMD)肌病。外泌体生物学领域的重大进展为治疗干预创造了新的可能性。外泌体可以被工程化以递送治疗性载荷,并能够靶向特定的细胞或组织。鉴于对外泌体促进肌肉再生的兴趣日益增长,该研究在一个DMD模型中研究了磁性递送的有效性。为了调节营养不良骨骼肌的炎症环境,该研究富集了ANXA1(一种在抗炎和修复机制中起促进作用的介质)的外泌体。在体外实验中,富集的外泌体有效地促进了促炎巨噬细胞向抗炎状态的转变,并促进了营养不良肌肉祖细胞的肌源性成熟。在体内实验中,利用铁磁纳米载体进行系统注射后的受控递送和肌肉积累。通过每周反复给药,mdx小鼠中观察到了有效的肌肉修复。外泌体被浸润的巨噬细胞吸收后,抑制了炎症通路并导致肌肉纤维中的代谢转变,增强了氧化代谢。这种肌肉纤维与巨噬细胞的相互作用减少了肌肉纤维的重塑,从而改善了肌肉收缩。所提出的基于纳米载体的方法是一种经济高效且低成本的发展治疗性外泌体的策略,能够改善肌营养不良患者的生活质量。Villa C, et al. Magnetic-field-driven targeting of exosomes modulates immune and metabolic changes in dystrophic muscle. Nat Nanotechnol. 2024 Jul 22. doi: 10.1038/s41565-024-01725-y. PMID: 39039121.外泌体资讯网 【Nat Nanotechnol】磁场驱动的外泌体靶向调节营养不良肌肉的免疫和代谢变化
 炎症的及时解决对于在感染或损伤后恢复肌肉稳态,并避免包括肌营养不良在内的慢性炎症病理是必要的。巨噬细胞在这一过程中起着关键作用,因为它们能够从通常的促炎状态转变为抗炎表型。工程化外泌体是<200纳米的细胞外囊泡,能够携带多种信号生物分子,包括免疫介质,如AnxA1(Annexin A1),后者已成为巨噬细胞极化的关键调节因子。先前关于外泌体递送用于治疗不同形式的肌营养不良的研究结果令人鼓舞,表明精确操控外泌体可以促进病理过程中的组织修复。
炎症的及时解决对于在感染或损伤后恢复肌肉稳态,并避免包括肌营养不良在内的慢性炎症病理是必要的。巨噬细胞在这一过程中起着关键作用,因为它们能够从通常的促炎状态转变为抗炎表型。工程化外泌体是<200纳米的细胞外囊泡,能够携带多种信号生物分子,包括免疫介质,如AnxA1(Annexin A1),后者已成为巨噬细胞极化的关键调节因子。先前关于外泌体递送用于治疗不同形式的肌营养不良的研究结果令人鼓舞,表明精确操控外泌体可以促进病理过程中的组织修复。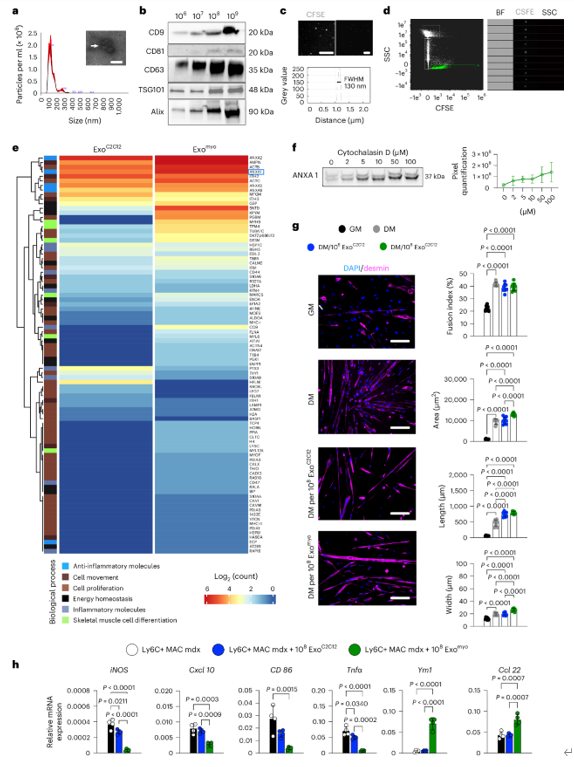

 炎症的及时解决对于在感染或损伤后恢复肌肉稳态,并避免包括肌营养不良在内的慢性炎症病理是必要的。巨噬细胞在这一过程中起着关键作用,因为它们能够从通常的促炎状态转变为抗炎表型。工程化外泌体是<200纳米的细胞外囊泡,能够携带多种信号生物分子,包括免疫介质,如AnxA1(Annexin A1),后者已成为巨噬细胞极化的关键调节因子。先前关于外泌体递送用于治疗不同形式的肌营养不良的研究结果令人鼓舞,表明精确操控外泌体可以促进病理过程中的组织修复。
炎症的及时解决对于在感染或损伤后恢复肌肉稳态,并避免包括肌营养不良在内的慢性炎症病理是必要的。巨噬细胞在这一过程中起着关键作用,因为它们能够从通常的促炎状态转变为抗炎表型。工程化外泌体是<200纳米的细胞外囊泡,能够携带多种信号生物分子,包括免疫介质,如AnxA1(Annexin A1),后者已成为巨噬细胞极化的关键调节因子。先前关于外泌体递送用于治疗不同形式的肌营养不良的研究结果令人鼓舞,表明精确操控外泌体可以促进病理过程中的组织修复。


