尽管头颈部鳞状细胞癌等癌症通常依赖于表皮生长因子受体(EGFR)的活性,但使用酪氨酸激酶抑制剂(TKIs)靶向野生型EGFR从未达到预期的成功疗效。来自新加坡国家癌症中心的研究人员发现,对TKIs表现出异常反应的个体具有导致EGFR异构体D(IsoD)过表达的遗传异常,EGFR IsoD被分泌在细胞外囊泡(EVs)或外泌体中,促进和转移TKI治疗的敏感性,证明了EVs可以作为TKI治疗的辅助药物的可行性。相关研究以“Therapeutic application of extracellular vesicular EGFR isoform D as a co-drug to target squamous cell cancers with tyrosine kinase inhibitors”为题在线发表于7月25日的国际知名学术期刊Developmental Cell杂志上。
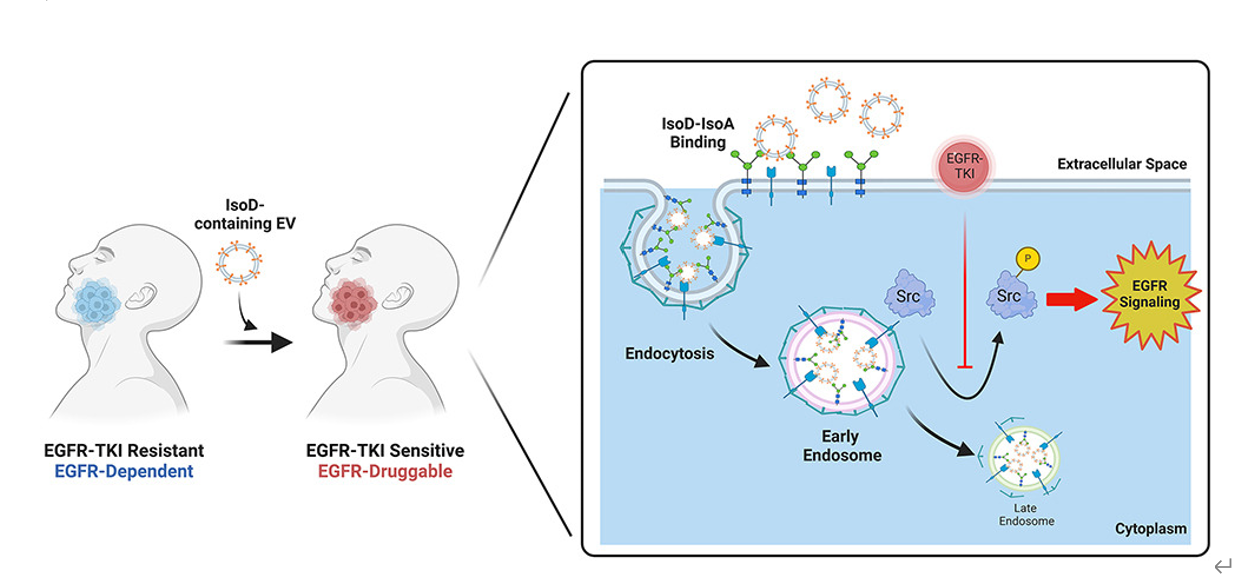
尽管表皮生长因子受体(EGFR)通路在癌症中的潜力巨大,使用酪氨酸激酶抑制剂(TKIs)靶向这一通路在大多数依赖于EGFR的癌症中并不是全部有效。这种TKI治疗效果不佳的情况尤其在鳞状细胞癌中尤为明显,这是全球最常见的致命癌症之一。这些癌症起源于包括头颈部、肺部、食管、膀胱、肛门和子宫颈在内的不同解剖部位。大规模的组学特征分析发现,这些癌症存在许多功能和基因组相似性,包括EGFR信号的过表达和依赖性。然而,使用小分子TKIs靶向野生型EGFR在大多数情况下的作用有限。这与EGFR突变的肺腺癌不同,针对EGFR突变的药物成功的关键在于识别特定的EGFR激活突变。对于头颈鳞状细胞癌(HNSCC),作为典型的鳞状细胞癌,超过80%的肿瘤表现出EGFR过表达,与患者存活率降低相关。然而,队列基因研究显示,在EGFR外显子18-21中的激活突变是罕见事件,而EGFR扩增不能预测对TKI治疗的反应。此外,靶向EGFR下游信号通路的研究取得了少量成功的结果,没有明确的生物标志物被确认,这也支持了靶向EGFR或其通路尚未实现功能研究所宣称的强大的抗癌潜力的观点。EGFR及其下游信号传导无疑是癌症中研究最广泛的通路之一。野生型EGFR,如EGFR异构体A(IsoA),通常由其七种已知配体之一激活,导致受体二聚化,其酪氨酸激酶结构域的跨自磷酸化,以及下游效应分子的招募,包括丝裂原活化蛋白激酶(MAPK)、磷酸肌醇3-激酶(PI3K)、磷脂酶C-gamma1(PLC-γ1)和原癌基因酪氨酸蛋白激酶Src(SRC)信号通路。这些通路随后控制细胞过程,如细胞增殖、分化、迁移和抑制凋亡。此外,生理浓度下的配体结合触发细胞膜上的受体向核内聚集和网格蛋白依赖的内吞作用,通过内体区继续受体介导的信号传导,最终通过内溶体途径清除受体,导致信号级联的下调。相比之下,激活型EGFR突变即使在无配体存在时也能发出信号,被认为处于增强的内体运输但受损的溶酶体清除状态。此外,一些这些突变还似乎增强了细胞内内体信号传导。尽管已开发了许多TKIs以靶向激酶结构域的活性ATP结合位点,并通过优化后代TKIs与EGFR的亲和性以克服EGFR突变体中的TKI抗药性,但在野生型EGFR扩增或其空间信号传导方面的研究明显较少。研究团队此前曾报道了通过分析EGFR TKI的特异和罕见反应者,鉴定了一个长链非编码RNA(lncRNA)作为反应的生物标志物。在那项研究中,研究展示了EGFR中的单核苷酸多态性Q787Q影响了EGFR-AS1 lncRNA的稳定性,进而影响了EGFR的剪接。对于对EGFR TKI有反应的患者的肿瘤,显示出较高的EGFR异构体D(IsoD)与IsoA表达比,表明可能存在额外的调控层次,能够选择对EGFR-TKI治疗有反应的患者。尽管有研究探讨了蛋白水解产物EGFR碎片(也称为分泌的EGFR,sEGFR)及其预测TKI反应的能力,但关于EGFR mRNA剪接变异体(IsoA-H)的角色的数据非常匮乏。有趣的是,最近的报告将增加的EGFR IsoD mRNA表达与表皮生长因子(EGF)或神经调节因子-1β(NRG-1β)处理相关联;然而,这种增加表达的功能后果尚不明确,进一步强调了研究该蛋白的必要性。基于这些发现,研究人员推测,观察到的增加敏感性的表型可能通过EGFR IsoD蛋白介导,鉴于其推测的结构,这种蛋白可能会被分泌。IsoD缺乏一个整合的跨膜和激酶结构域,并以TKI敏感的患者来源培养物中外泌体(EVs)的形式分泌。EV中的IsoD蛋白可以将对TKIs的敏感性转移至TKI耐药的肿瘤细胞,并且在多种模型和药物中是必要且充分的。这种药物反应需要完整的内吞机制,与全长EGFR的结合,并通过内体区的Src磷酸化进行信号传导。研究人员提出使用含有EGFR IsoD的EVs作为药物共同治疗策略,以扩展TKI疗法在EGFR驱动的癌症中的应用。参考文献:Therapeutic application of extracellular vesicular EGFR isoform D as a co-drug to target squamous cell cancers with tyrosine kinase inhibitors. Dev Cell. 2024 Jul 25:S1534-5807(24)00442-8.




