随着社会经济发展及生活方式的改变,如今,全球有1/3的人口超重或者肥胖。肥胖给个人健康及公共卫生带来了沉重的负担,“一胖毁所有”并不是危言耸听。流行病学研究数据表明,肥胖患者骨折风险增加,肥胖给骨骼健康带来了不可承受之重,因此肥胖对骨骼的影响及其潜在机制值得探讨。组织巨噬细胞(脂肪组织巨噬细胞及骨髓巨噬细胞)是肥胖诱发机体慢性炎症并加剧组织/器官退化和细胞功能障碍的“罪魁祸首”,但巨噬细胞调控肥胖相关骨干/祖细胞谱系命运与骨退化的机制尚不明确。阐明巨噬细胞调控肥胖相关骨干/祖细胞谱系命运与骨退化的机制可为防治肥胖相关骨退化提供理论依据。2024年7月4号,中南大学湘雅医院李长俊教授团队在Bioactive Materials杂志上发表题为“Macrophage-derived extracellular vesicles regulate skeletal stem/progenitor Cell lineage fate and bone deterioration in obesity”的论文(2024 Jul 4:36:508-523),主要介绍了骨髓巨噬细胞通过释放细胞外囊泡调控肥胖相关的骨干/祖细胞谱系命运与骨退化。第一作者为中南大学湘雅医院内分泌科贺晨博士研究生,通讯作者为中南大学湘雅医院内分泌科研究员、老年骨关节疾病防治教育部重点实验室副主任、实验动物中心主任李长俊教授。
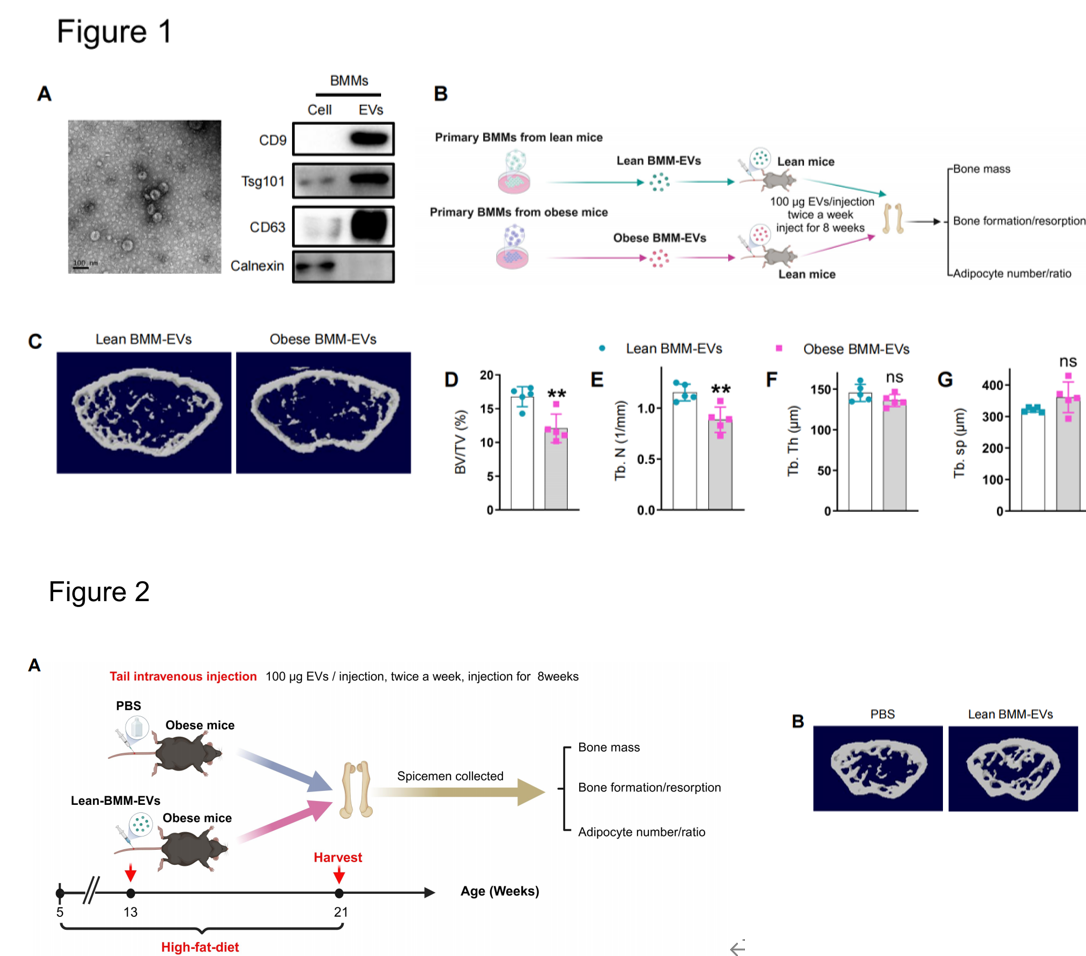
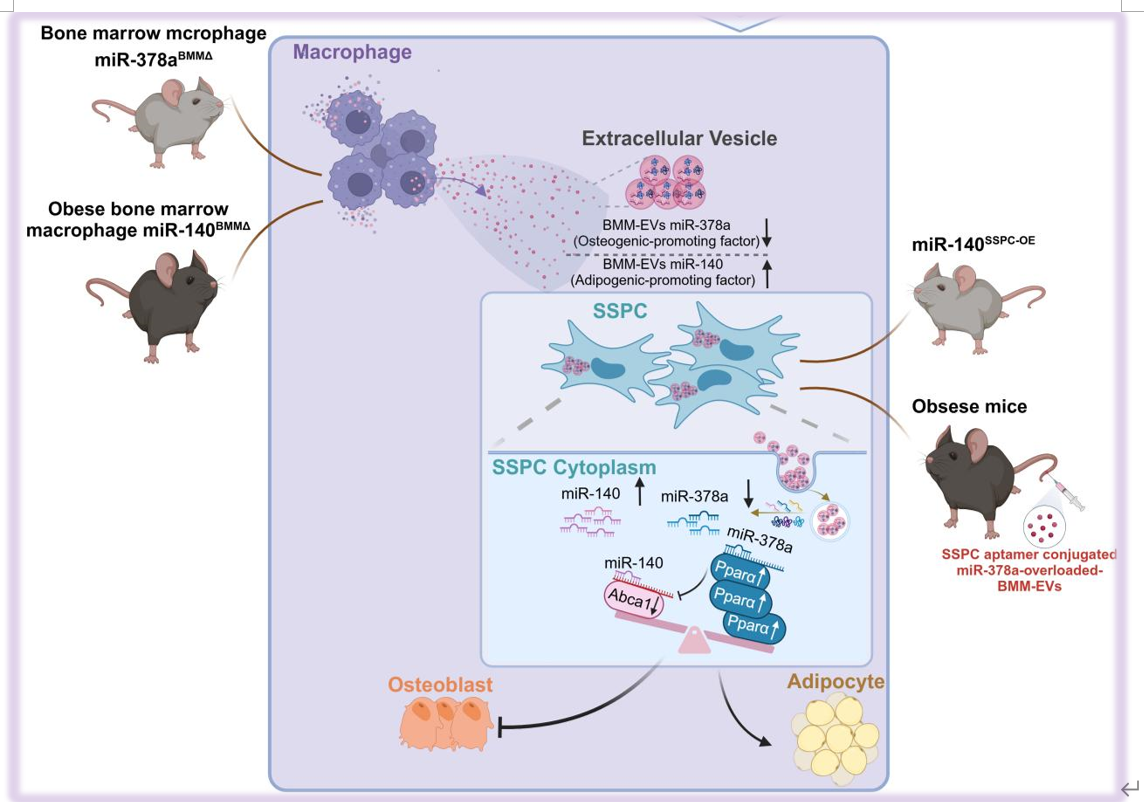
(1)高脂饮食诱导的肥胖小鼠的骨髓巨噬细胞(BMM)分泌含有microRNA的细胞外囊泡(BMM-EVs)导致骨退化(Figure 1),而普通饮食健康小鼠的BMM-EVs可使肥胖小鼠的骨骼恢复活力(Figure 2)。(2)BMM-EV miR-140(具有促成脂分化功能)和miR-378a(具有促成骨分化功能) (Figure 3)通过靶向Pparα-Abca1轴协同调控骨干/祖细胞(SSPCs)的成骨和成脂分化命运(Figure 6)。(3)首次报道BMMs条件敲除miR-140(Figure 4)和BMMs条件敲除miR-378a(Figure 5),以及在骨骼干/祖细胞中条件过表达miR-140(Figure 4)的转基因小鼠模型的骨表型。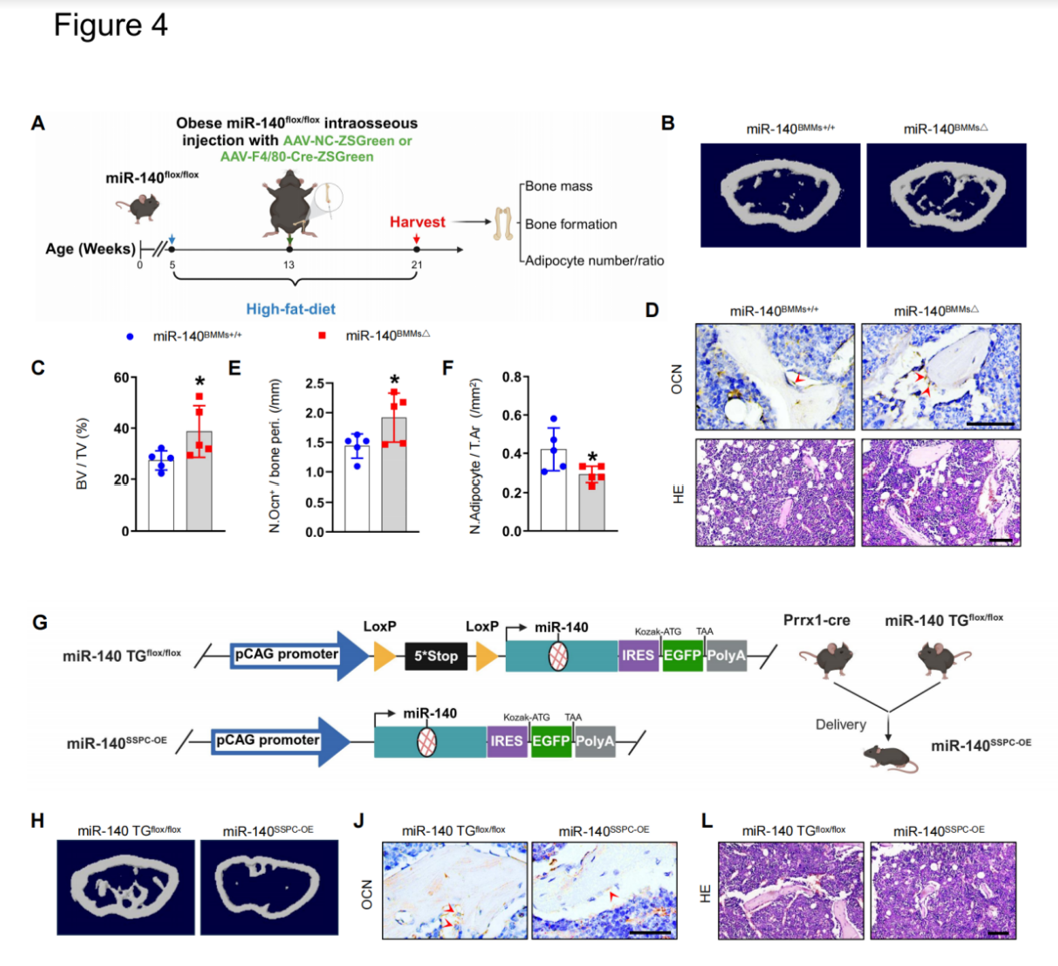
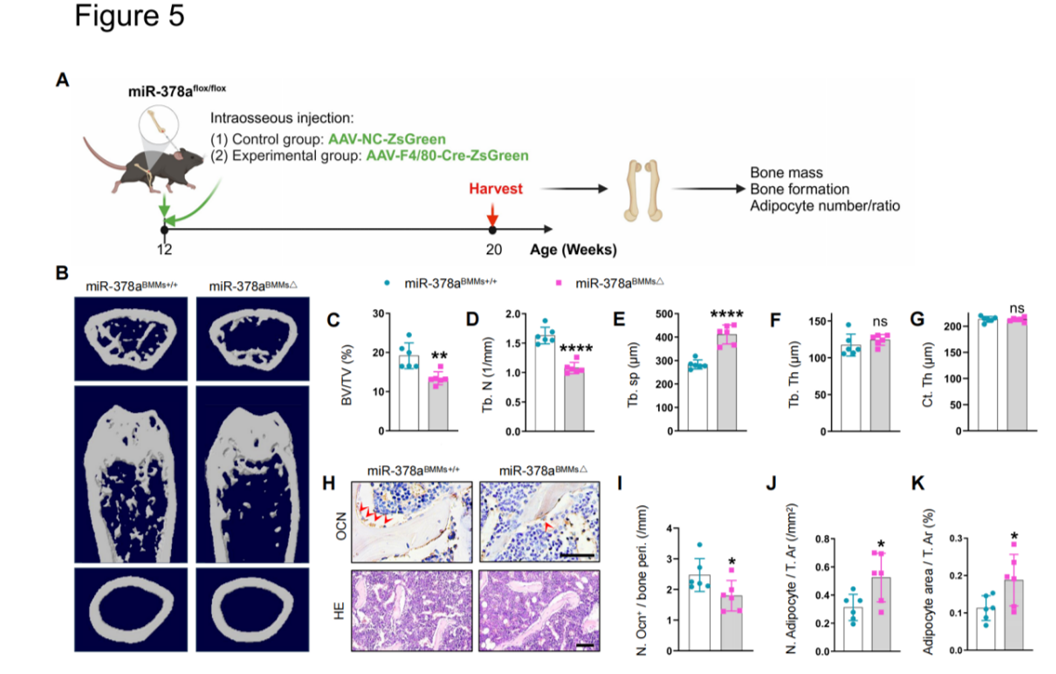
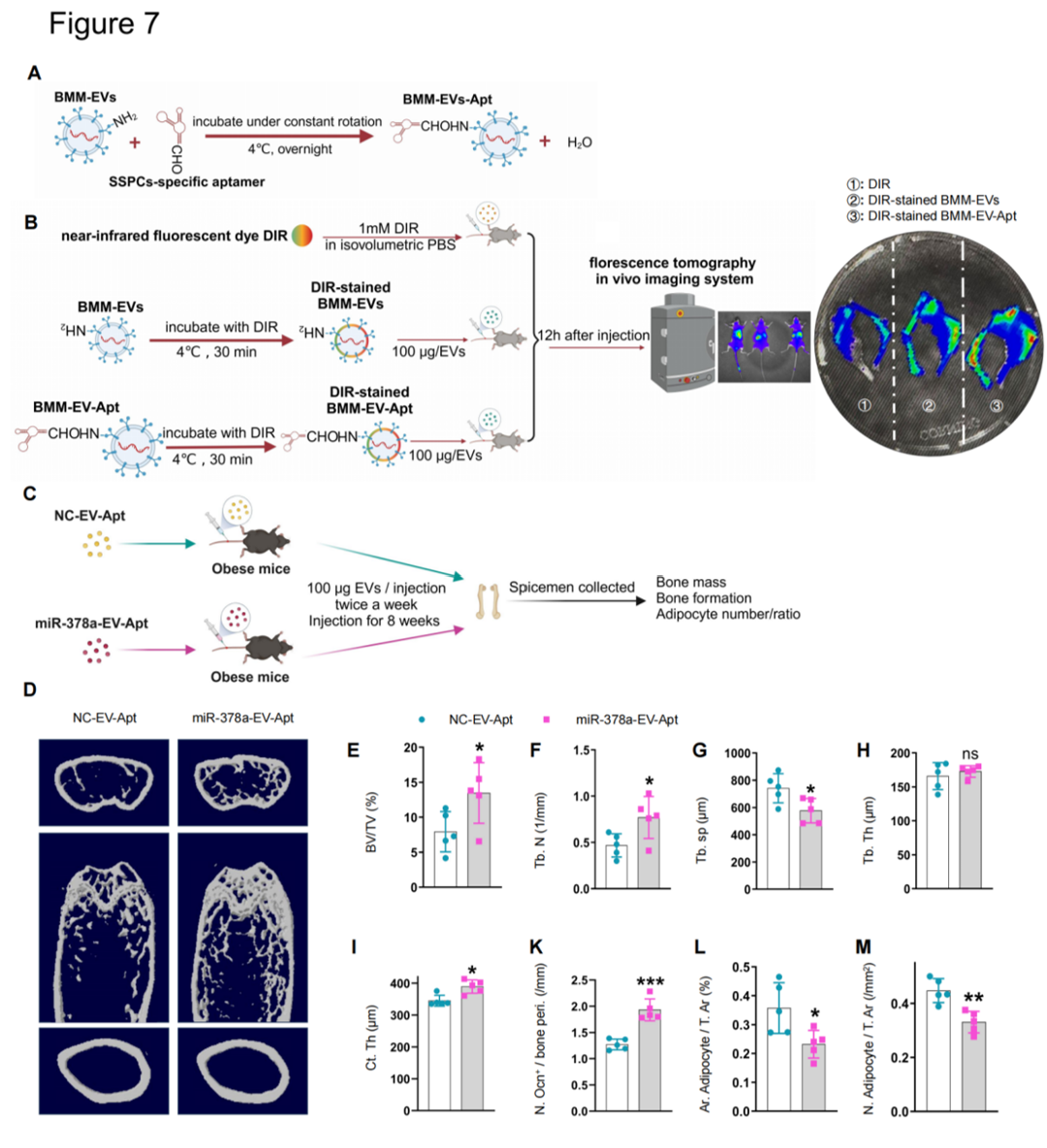
(4)使用骨干/祖细胞特异性靶向适配体,通过适配体修饰的细胞外囊泡递送系统将miR-378a过载的BMM-EVs时空特异性地递送到SSPC,改善了肥胖小鼠的骨退化(Figure 7)。综上所述,该研究表明肥胖引发巨噬细胞来源细胞外囊泡内容物的变化,从而加剧骨退化。肥胖小鼠的骨髓巨噬细胞细胞外囊泡(BMMs-EVs)处理普通饮食健康小鼠后,健康小鼠出现骨退化表型(骨体积分数减少,骨微结构恶化,脂肪细胞增加)。相反,普通饮食健康小鼠的BMMs-EVs尾静脉注射到肥胖小鼠后,可以使肥胖受体小鼠的骨骼恢复活力。此外,该研究发现,包裹在BMMs-EVs中的miRNA-140和miRNA-378a通过调节Pparα-Abca1轴协调调控骨干/祖细胞(SSPCs)的细胞命运。李长俊教授团队聚焦免疫及力学调控骨衰老研究方向,近年发表系列原创性成果,包括Cell metabolism 2021(巨噬细胞分泌GCA调控骨衰老), Science Bulletin 2024(力学调控破骨细胞分化及骨吸收), Bone Research 2024(巨噬细胞源性GCA调控骨膜干细胞衰老), Theranostics2024(力学调控骨膜干细胞分化功能)等。诚邀PI、技术员及博士后进行合作交流(lichangjun@csu.edu.cn)。Macrophage-derived extracellular vesicles regulate skeletal stem/progenitor Cell lineage fate and bone deterioration in obesity. Bioact Mater. 2024 Jul 4;36:508-523.doi: 10.1016/j.bioactmat.2024.06.035外泌体资讯网 Bioactive Materials|中南大学湘雅医院李长俊:发现巨噬细胞源性的细胞外囊泡可调控肥胖相关骨干/祖细胞谱系命运