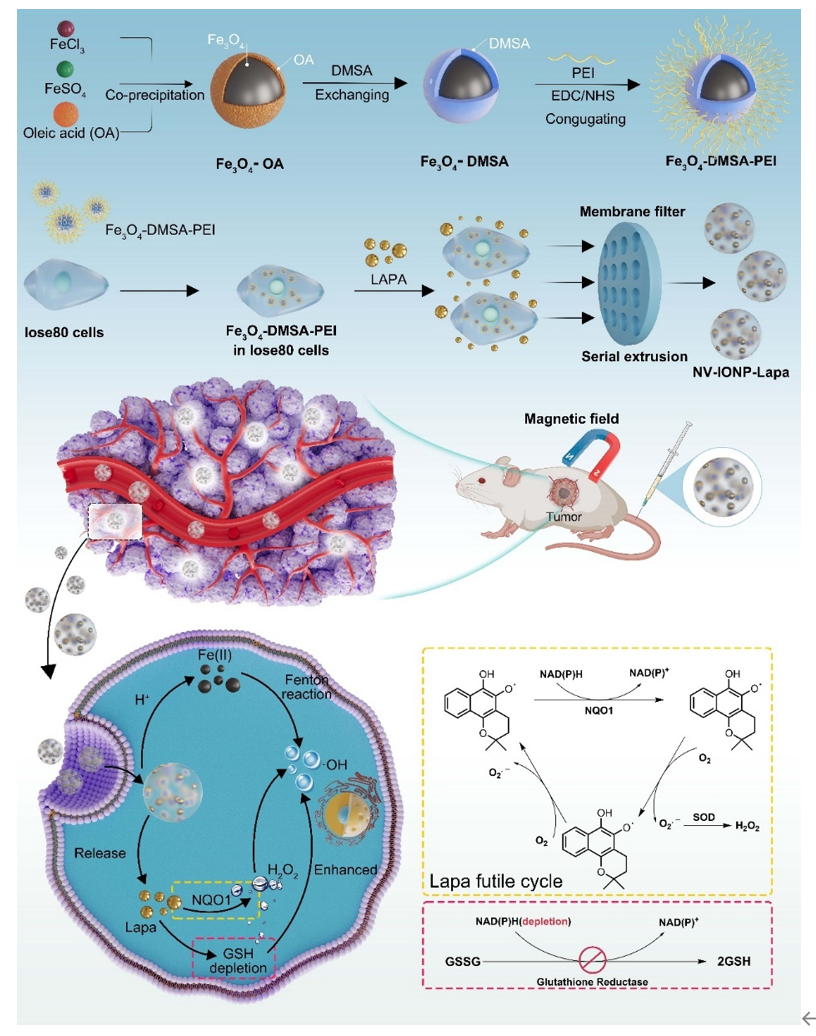
增强肿瘤活性氧生成,破坏氧化还原稳态,成为有效的抗肿瘤策略。化学动力学疗法(CDT)利用Fenton试剂将肿瘤原位H2O2转化为羟基自由基(•OH),具有较高的特异性,作为一种新兴的肿瘤干预技术而备受关注。然而,尽管H2O2在肿瘤微环境中的特异性过表达,其浓度仍不足以与Fenton试剂反应产生足够的•OH以达到理想的治疗效果。此外,肿瘤过表达内源性抗氧化物质以维持氧化还原稳态,如谷胱甘肽(GSH)表现出对•OH强大的清除能力,从而减弱CDT效应。
近日,东部战区疾病预防控制中心李宏/佛山复星禅诚医院黄浩/暨南大学附属第一医院王帅团队研究提出一种有前景NVs的药物递送策略,用于高NQO1表达肿瘤的治疗。相关内容以“Engineering Magnetic Extracellular Vesicles Mimetics for Enhanced Targeting Chemodynamic Therapy to Overcome Ovary Cancer.”为题发表在ACS applied materials & interfaces杂志上(2024 Jul 21)。
在这项研究中,研究者设计了一种同时负载四氧化三铁纳米颗粒(IONPs)及β-拉帕醌(Lapa)的胞外囊泡模拟物(Nanovesicles, NVs)载药平台,用于增强细胞氧化应激。通过正常卵巢上皮细胞连续挤出而产生的NV-IONP-Lapa具有良好的生物相容性,实现磁性介导下卵巢癌细胞摄入增强。Lapa在NADPH醌氧化还原酶1(NQO1)的催化下选择性生成H2O2。肿瘤酸性条件下,IONPs离子化产生Fe2+,通过 Fenton反应触发H2O2转化为•OH。同时,Lapa催化反应可通过无效循环清除肿瘤GSH,进一步放大氧化应激。NV-IONP-Lapa具有较强的磁靶向性和肿瘤生长抑制效应。
通过连续挤压法制备磁性NV-IONP-Lapa,具有与自然分泌胞外囊泡(EVs)相似的理化性质和生物学特性,展现出环境pH依赖的药物释放性质。
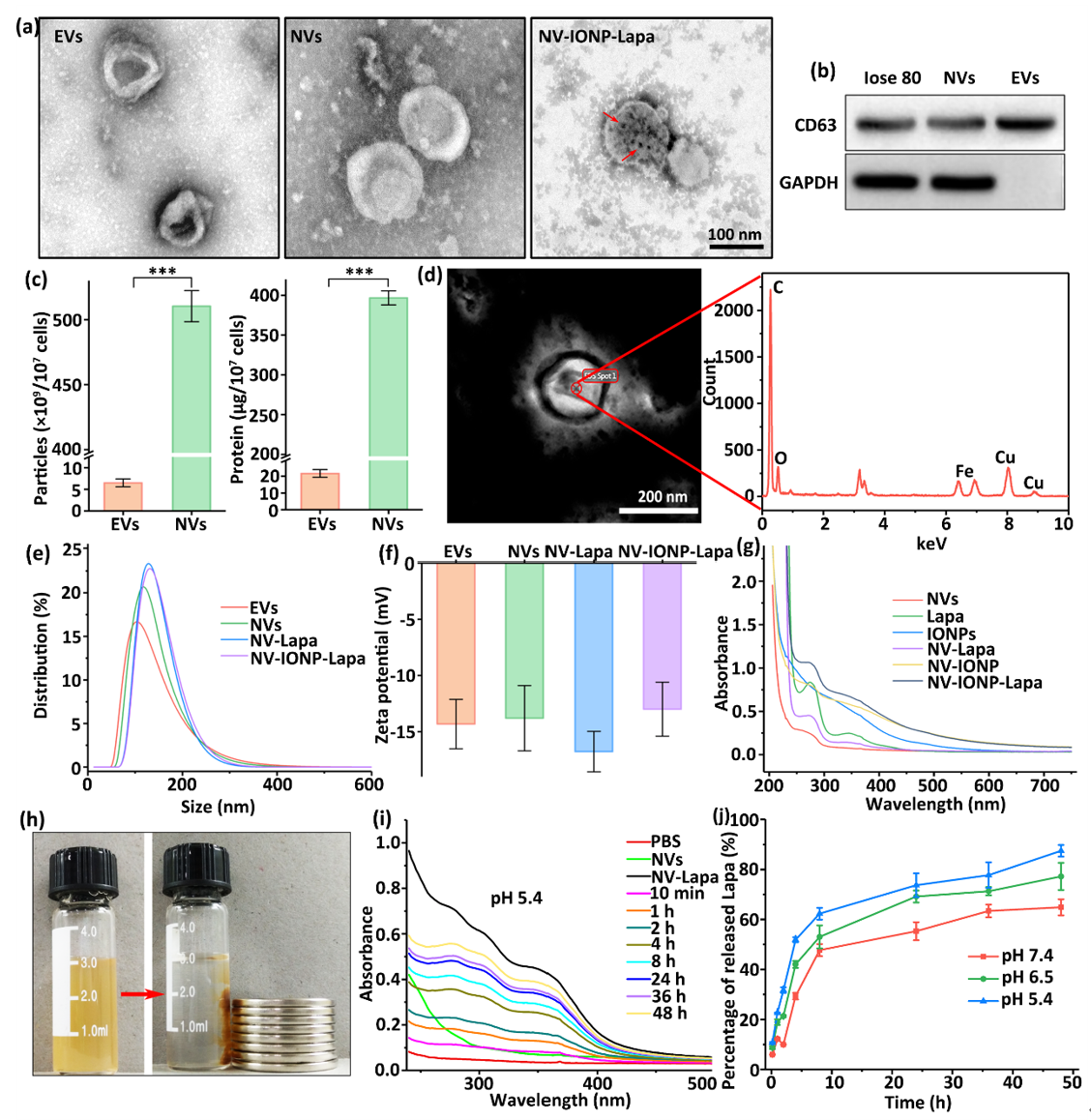 图2 NV-IONP-Lapa制备与特性分析
图2 NV-IONP-Lapa制备与特性分析
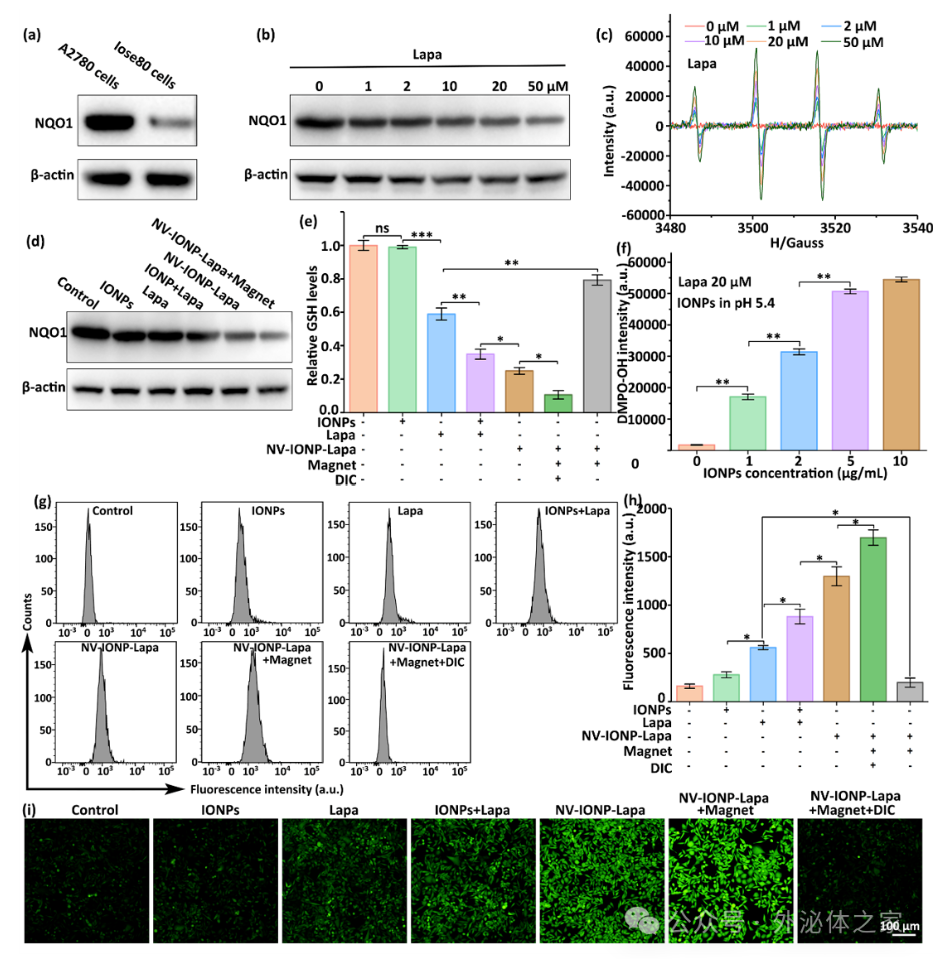
磁场作用增强了NV-IONP-Lapa细胞摄入,释放的Lapa在NQO1的催化下,产生H2O2,同时消耗细胞GSH,从而增强细胞活性氧产生和CDT效应。
磁场作用有效改善NV-IONP-Lapa的生物分布,减少肝脾等器官非特异性蓄积,增强载药系统的肿瘤靶向性,并实现MRI成像。此外,上述策略可有效促进小鼠肿瘤组织活性氧产生,降低GSH水平。
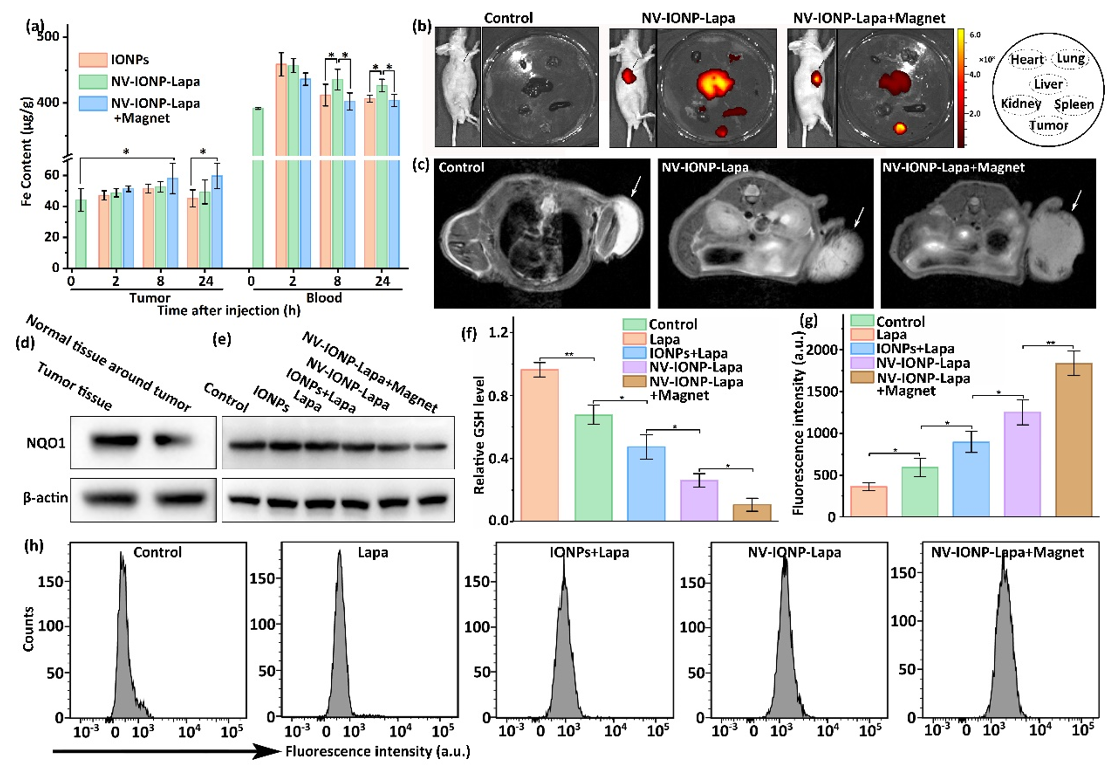 图4 体内NV-IONP-Lapa的肿瘤磁靶向及氧化应激放大效应
图4 体内NV-IONP-Lapa的肿瘤磁靶向及氧化应激放大效应
NV-IONP-Lapa联合磁场具有优异的肿瘤生长抑制效果,并显示出较高的生物安全性。
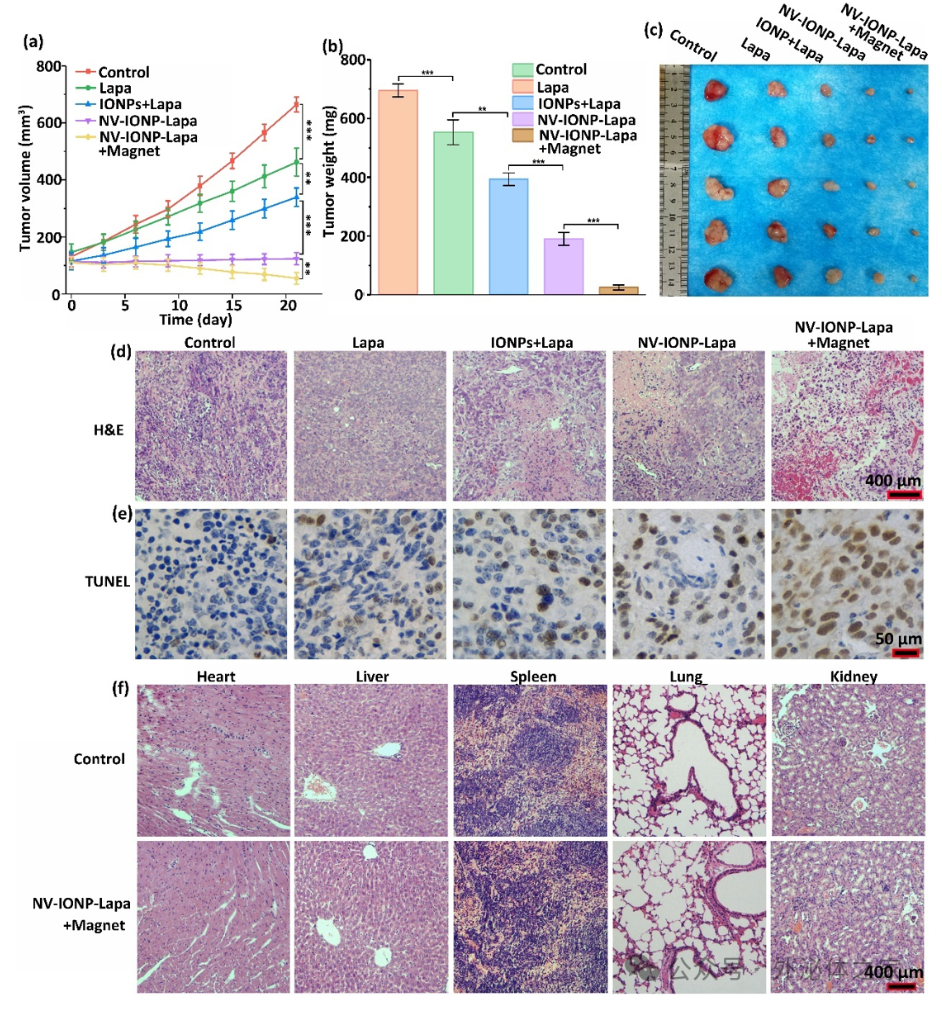 图5 磁场的介导下NV-IONP-Lapa的肿瘤生长抑制效应参考文献:Engineering Magnetic Extracellular Vesicles Mimetics for Enhanced Targeting Chemodynamic Therapy to Overcome Ovary Cancer. ACS Appl Mater Interfaces. 2024 Jul 21. doi: 10.1021/acsami.4c06862.
图5 磁场的介导下NV-IONP-Lapa的肿瘤生长抑制效应参考文献:Engineering Magnetic Extracellular Vesicles Mimetics for Enhanced Targeting Chemodynamic Therapy to Overcome Ovary Cancer. ACS Appl Mater Interfaces. 2024 Jul 21. doi: 10.1021/acsami.4c06862.
外泌体资讯网 ACS Appl Mater Interfaces|李宏/黄浩/王帅:工程化磁性胞外囊泡模拟物用于增强卵巢癌靶向光动力学治疗