急性主动脉夹层(AD)是一种具有高死亡风险的心血管疾病,目前临床上最主要的治疗手段是手术干预,然而手术干预会引起血管的继发性损失,血管支架也会诱发免疫排斥和其他不良反应。为提高治疗效果,制定积极有效的AD早期干预和预防治疗策略势在必行,尤其是基于分子靶向的治疗策略。
为解决这一问题,青岛大学转化医学研究院于涛教授研究团队提出了一种全新的靶向递送基因疗法新策略。相关研究发表在Advanced Healthcare Materials杂志上,题为“Oral Piwi-Interacting RNA Delivery Mediated by Green Tea-Derived Exosome-Like Nanovesicles for the Treatment of Aortic Dissection”(2024 Aug 1:e2401466)。文章的第一作者是博士生刘燕和亓洪昭助理教授,通讯作者是青岛大学于涛教授和韩国成均馆大学Jae Youl Cho教授。
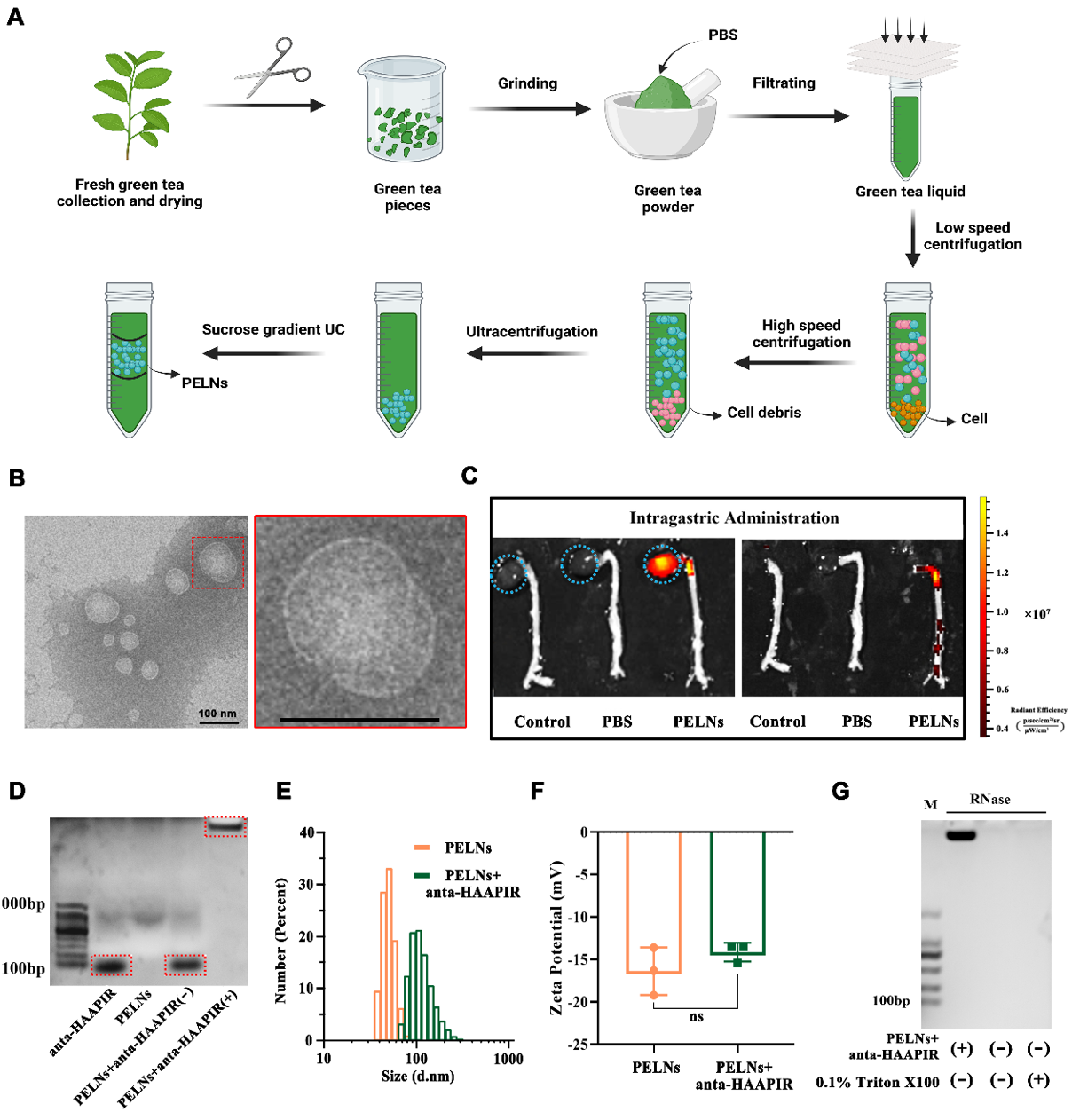
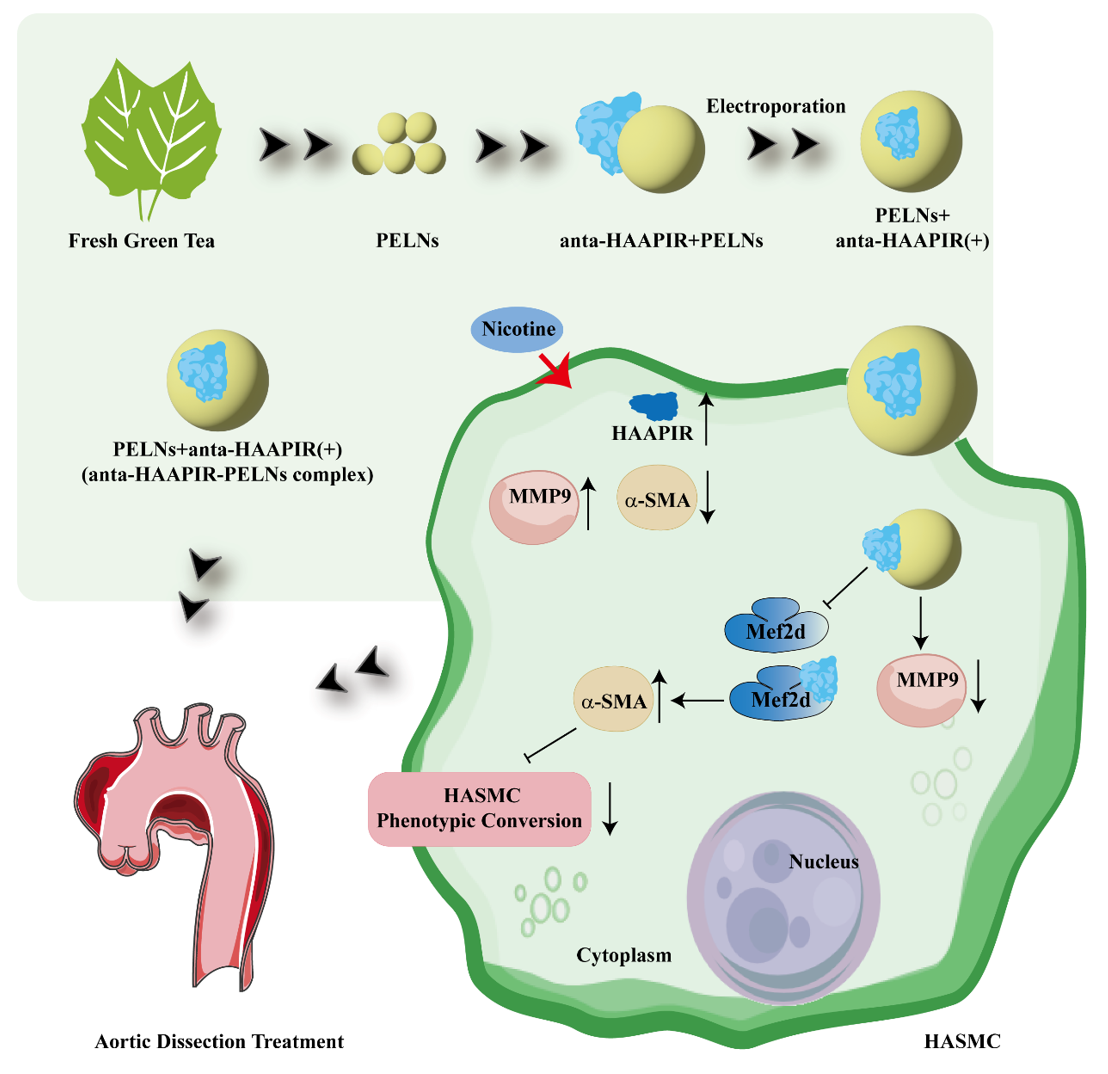
该工作提取了绿茶衍生的外泌体样纳米囊泡作为口服核酸的递送载体,包载心脏凋亡相关piRNA-HAAPIR 的拮抗剂靶向递送到主动脉夹层损伤部位,可通过Mef2D 和 MMP9 通路有效调节血管重塑,减轻主动脉夹层的发生。研究发现经过纯化的绿茶外泌体样纳米囊泡和HAAPIR拮抗剂复合物表现出较高的包载率和对核酸酶降解的抵抗力。小鼠给药治疗时,该复合物高效靶向主动脉夹层的病变部位,降低了主动脉夹层的发生率并提高了小鼠的生存率。此外,MMP9和Mef2D的表达显著降低,抑制了主动脉平滑肌细胞的表型转换。综上,绿茶衍生的植物外泌体样纳米囊泡维持了递送核酸的稳定性,其作为口服载体介导小分子核酸通过消化系统转运到血液循环系统,并将此分子靶向递送到主动脉夹层发生部位。因此,HAAPIR是持续性临床主动脉夹层预防和治疗的潜在靶点,而口服绿茶外泌体样纳米囊泡包封核酸治疗主动脉夹层提示了一种有前途的心血管疾病治疗策略。这项研究引进新型主动脉夹层核酸治疗新方法,提出口服绿茶外泌体样纳米囊泡的关键靶向作用。初步解决了主动脉夹层治疗的难点和手术带来的弊端。首先对绿茶外泌体类纳米囊泡进行分离提纯和表征的检测。研究采用新鲜绿茶,差速离心法进行外泌体类纳米囊泡的分离,随后使用蔗糖密度梯度离心法对其纯化 (图1A),得到的PELNs进行形态学鉴定,发现PELNs近乎球形(图1B)。同时,在小鼠体内,发现标注了CY5.5的PELNs聚集在心脏和血管部位,生理盐水灌注后消失,表明PELNs 通过消化系统进入体内血液循环(图1C)。与此同时,对其包封率,粒子大小和电位,以及对核酸酶稳定性分别进行筛选和优化(图1D-G)。
图1 茶叶中PELNs的分离和表征为了评估anta-HAAPIR-PELN复合物在体内的治疗效果,四组对照和AD小鼠(n = 15)通过分别通过灌胃给予生理盐水,NC-PELENs和Cy5标记的anta-HAAPIR-PELN复合物,灌胃给药anta-HAAPIR-PELN复合物进行治疗,7天后腹腔注射给予Ang2和BAPN诱导AD模型约2周,实验期为21天。分别观察牺牲后的小鼠主动脉的夹层变化(图3B-C),生存曲线(图3D)以及血管形态及血流轮廓(图3E-F),发现anta-HAAPIR-PELN复合物治疗的小鼠,主动脉夹层得到明显改善。同时,为了评估AD过程中的组织结构,进行了苏木精和伊红(H&E)染色,马松染色,弹性纤维和胶原纤维(EVG)染色。结果显示,药物诱导AD组血管直径明显扩张,扩张区域伴有弹性纤维断裂,而NC-PELN和anta-HAAPIR-PELN治疗组未出现明显的弹性纤维破裂或直径增大(图4A)。免疫组化和蛋白免疫印迹检测MMP2、MMP9和-SMA的表达,结果显示AD组MMP9显著升高,但NC-PELN和anta-HAAPIR-PELN处理后, MMP9的表达水平下降(图4B-D)。而对细胞凋亡没有显著影响(图4E)。随后我们对材料的体内安全性进行检测,发现在anta-HAAPIR-PELN给药后,在小鼠中没有观察到细胞毒性或可检测到的不良副作用(图5)。
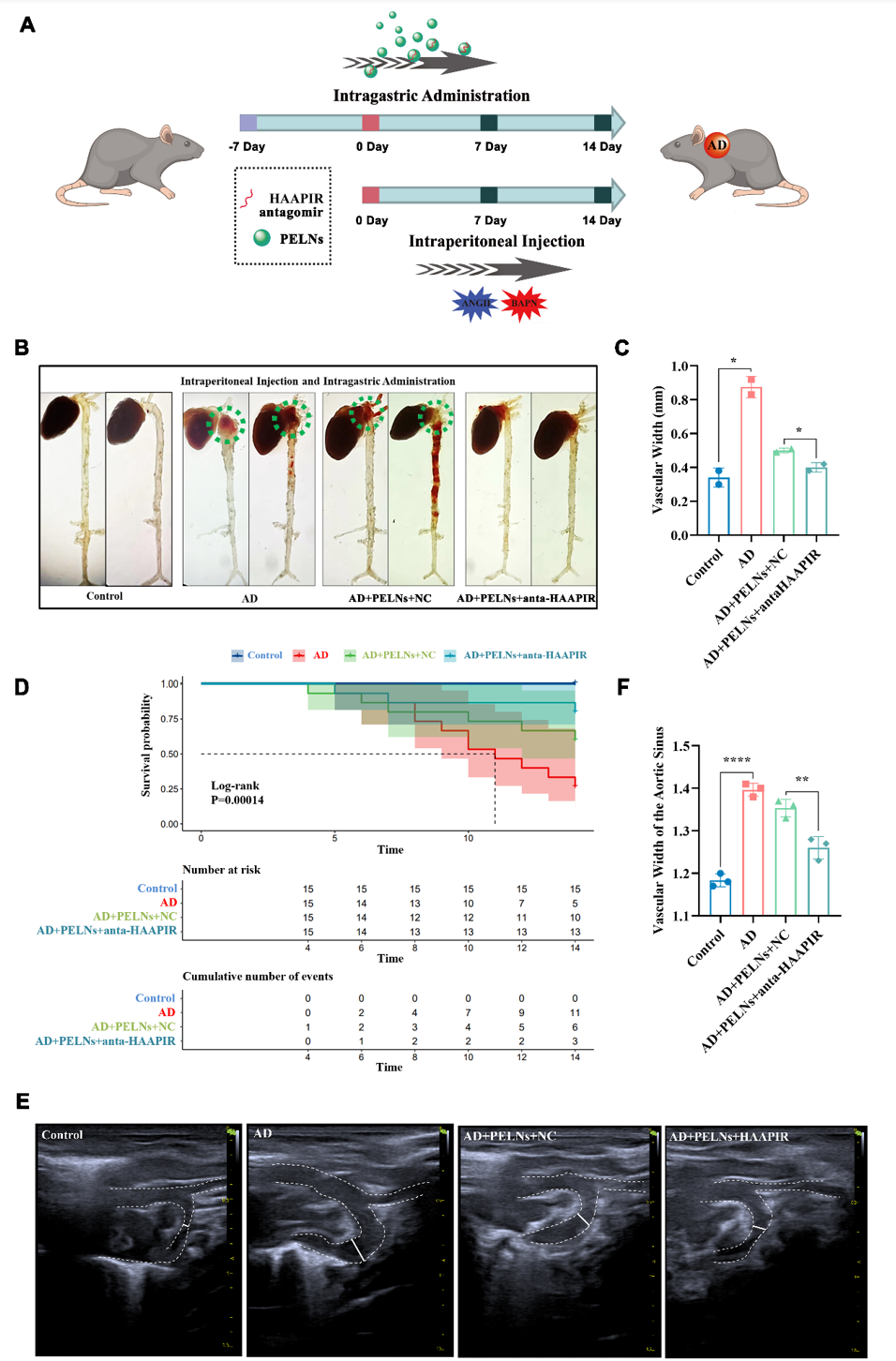
图 3:Anta-HAAPIR-PELNs复合物可有效治疗主动脉夹层A. AD动物模型设计的示意图。 B.心脏和主动脉的完整示意图显示了对照组 AD + PELNs和AD + PELNs + anta-HAAPIR中主动脉夹层发生的位置。绿色圆形:主动脉夹层部位。C. 钢尺检测的主动脉夹层血管宽度。单位:mm。 D. 对照组、AD、AD+PELNs和AD+PELNs+anta-HAAPIR组的生存曲线图。E-F. 采用超声波检查测量主动脉血管状况。白线:主动脉血管的宽度。数据以 SEM ±Mean(N=3) 表示。*P<0.05, **P<0.01, ****P<0.0001.
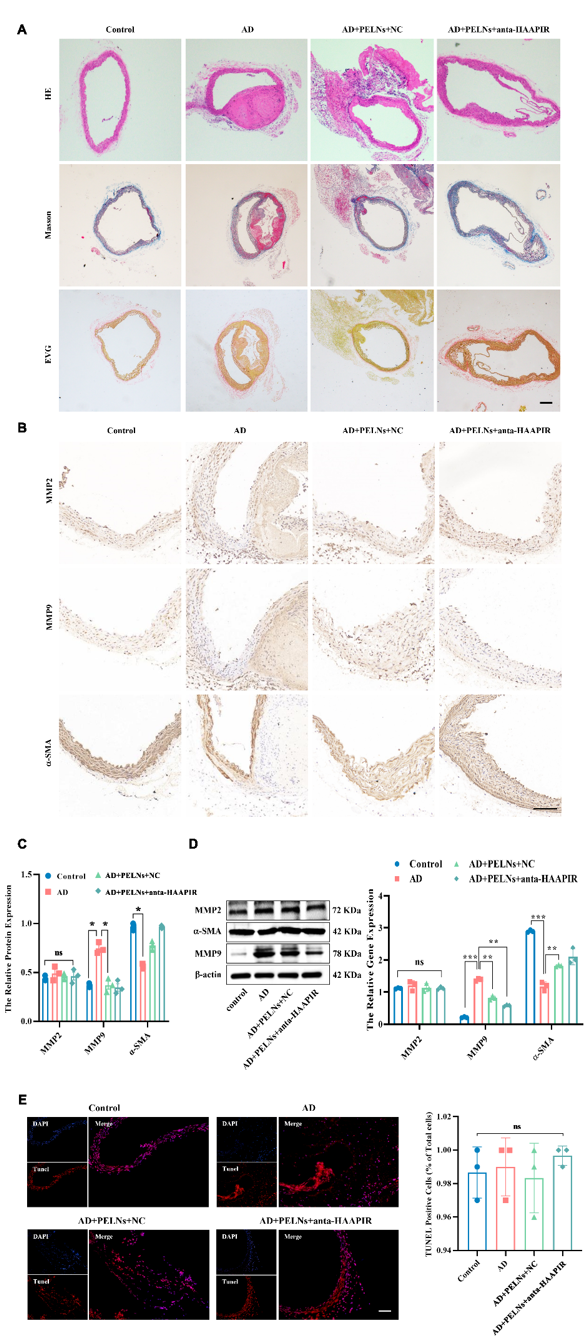
图 4:Anta-HAAPIR-PELNs复合物治疗A. H&E、Masson和EVG染色显示对照组、AD、AD+PELNs和AD+PELNs+anta-HAAPIR组的形态。Bar=200 m. B-C.免疫组化法检测MMP2、MMP9和-SMA的表达。Bar=100 m. D. 蛋白印迹检测MMP2、MMP9和-SMA的表达。E. TUNEL法检测组织中的细胞凋亡。Bar=100 m。所有定量数据均表示 SEM ±Mean(N=3)。*P<0.05, **P<0.01, ***P<0.001, ****P<0.0001.
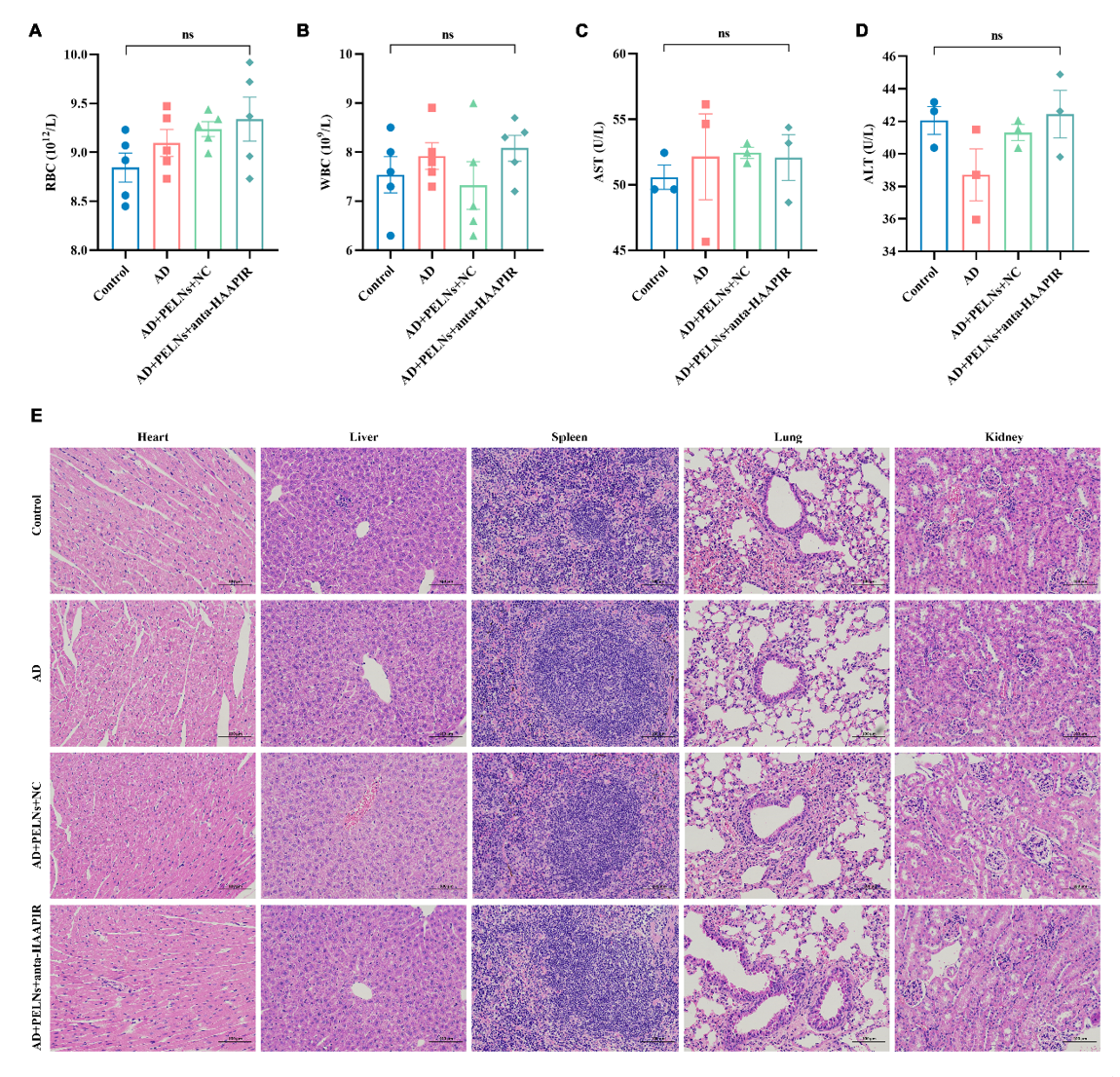
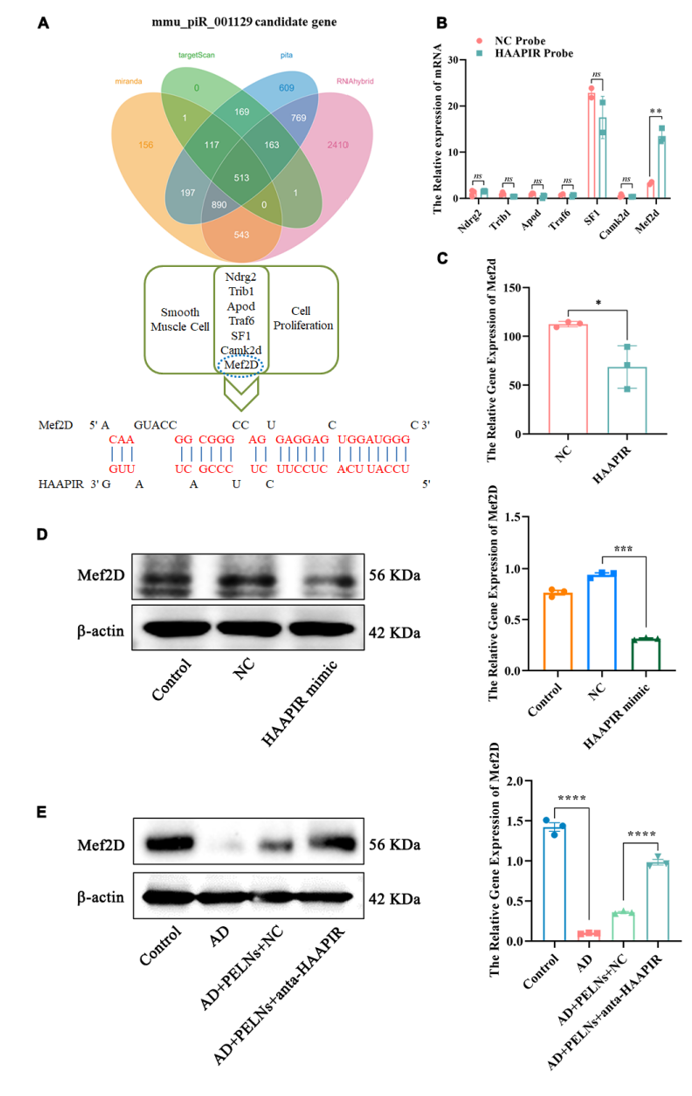
图5:anta-HAAPIR-PELNs在体内和体外的安全性评估A-B.红细胞(红细胞)和白细胞(白细胞)在不同四组的血清中计数。 C-D. 天冬氨酸转氨酶 (AST) 和丙氨酸转氨酶 (ALT) 用于检测小鼠血清,以检查肝损伤。 E. H&E染色结果显示,不同组小鼠的心、肝、脾、肺、肾无差异。Bar=100 m。数据以 SEM ±Mean(N=3)表示。为了进一步探索anta-HAAPIR-PELN复合物在AD修复中的作用机制,作者利用生物信息学分析来预测HAAPIR的下游靶点,并鉴定了513个基因(图7A)。随后,对这些基因的信号通路进行GO分析,发现7个基因与主动脉夹层和HASMC密切相关。 基于此,作者进行了RNA富集实验以检测这7个基因与HAAPIR的结合,这表明只有Mef2D被HAAPIR特异性富集(图7B)。为了澄清这一点,将先前过表达的 HAAPIR 探针转染到 HASMC 中,以检测 Mef2D 表达。发现两种监管模式之间存在负相关关系(图7C)。STRING网站用于预测Mef2D和HAAPIR的结合序列(图7A)。进行蛋白质印迹法测量Mef2D表达,结果表明,当HAAPIR过表达时,与对照组相比,Mef2D表达急剧降低(图7D)。体内实验证实了相同的结果,其中在用anta-HAAPIR-PELN复合物处理后,Mef2D表达显著增加(图7E)。同时,在RNA水平检测不同动物组HAAPIR、MMP9和-SMA的表达。结果表明,HAAPIR在AD组中高表达,而anta-HAAPIR-PELN复合物治疗组中HAAPIR的表达明显降低。MMP9表达显示出相同的趋势。这些结果表明,anta-HAAPIR-PELN复合物可以通过Mef2D通路治疗主动脉夹层。因此,anta-HAAPIR-PELNs-Mef2D信号通路可作为主动脉夹层临床诊断和治疗的潜在靶点。
图 7:Anta-HAAPIR通过靶向 Mef2D 发挥作用A.利用生物信息学方法对HAAPIR的下游靶点进行分析,并用维恩图表示。 B. RNA富集法检测了HASMCs中的7个基因,qRT-PCR检测了NC和HAAPIR两组中的7个基因表达。 C.在HASMC中过表达HAAPIR,qRT-PCR检测Mef2d的表达。D. 蛋白免疫印迹检测Mef2d在HAAPIR过表达的HASMCs和对照中的表达情况。 E. 蛋白免疫印迹检测不同组小鼠终Mef2d的表达。所有定量数据均表示 SEM ±Mean(N=3)。*P<0.05, **P<0.01, ***P<0.001, ****P<0.0001.综上所述,作者探索了HAAPIR在主动脉夹层中的发病机制,并将其作为治疗主动脉夹层的靶点。作者开发了一种基于口服绿茶衍生的外泌体样纳米囊泡的新型anta-HAAPIR递送系统,该系统可实现anta-HAAPIR的有效口服给药用于主动脉夹层治疗,有可能进一步促进口服核酸药物的开发(图8)。
参考文献:Liu, Yan et al. “Oral Piwi-Interacting RNA Delivery Mediated by Green Tea-Derived Exosome-Like Nanovesicles for the Treatment of Aortic Dissection.” Advanced healthcare materials, e2401466. 1 Aug. 2024, doi:10.1002/adhm.202401466原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adhm.202401466
外泌体资讯网 Adv Healthcare Mater|口服绿茶衍生的外泌体样纳米囊泡介导的小分子piRNA 递送治疗主动脉夹层