细胞外囊泡(EVs)是未来有前景的治疗方法,但其在体内给药后的不稳定性仍然是其进一步发展的重要障碍。许多研究团队评估过EV表面修饰策略,旨在控制EV的生物分布。相反,关注其稳定性以获得“免疫隐形”的异体EV的研究较少。调节EV稳定性和生物分布是将其开发为纳米治疗药物的必要前提。来自法国蒙彼利埃大学的研究人员探索了与EV膜结合的脂质锚定聚恶唑啉(POx化EV,作为PEG化的替代品),以在血浆中稳定EV并控制其生物分布,同时保持了其原有特性。相关内容以“Surface modification of extracellular vesicles with polyoxazolines to enhance their plasma stability and tumor accumulation”为题在线发表于8月5日的国际知名材料学期刊Biomaterials杂志上。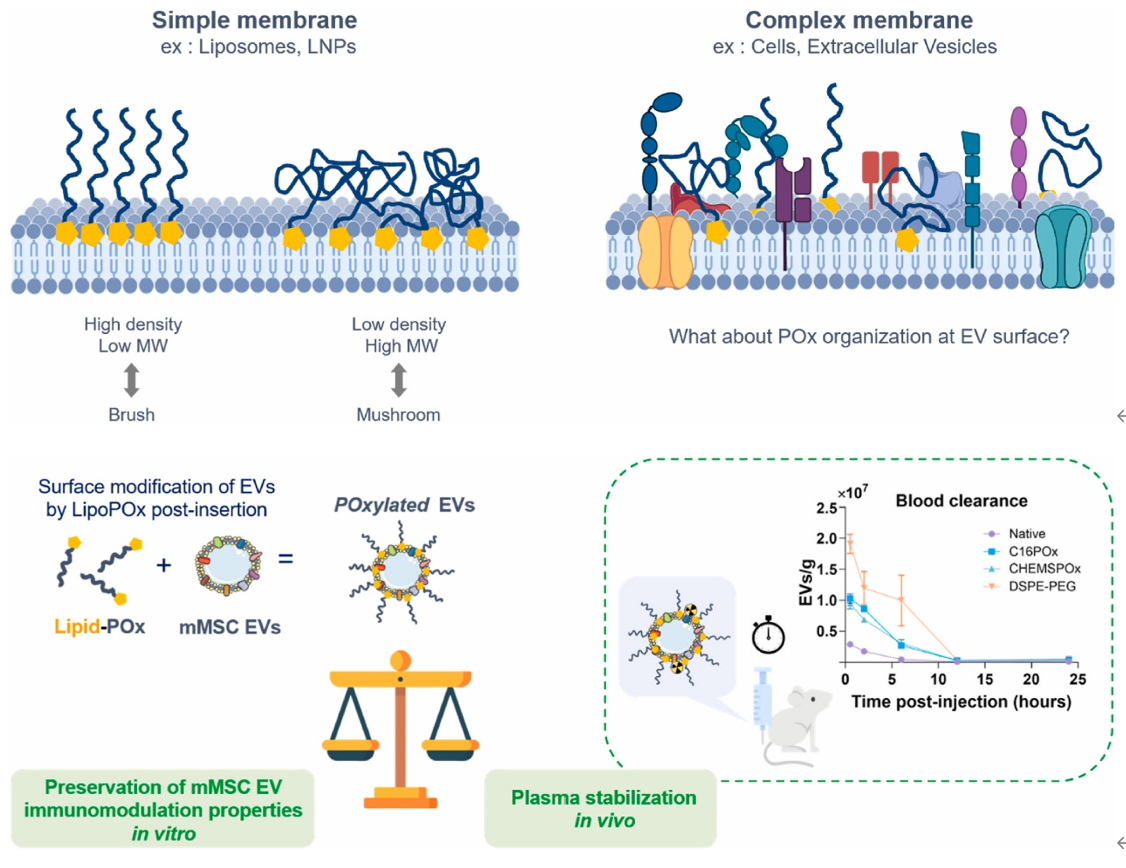
细胞外囊泡(EVs)是由细胞自然产生的纳米级囊泡。它们由一个亲水核心组成,核心中包含生物活性分子(即碳水化合物、蛋白质、核酸),外面被复杂的磷脂双层包围,包含表面和跨膜蛋白。由于其在细胞间转移生物分子的能力,EVs 是细胞间通讯的关键介导者,并显示出治疗和诊断的潜力。然而,要充分利用EV的治疗潜力,必须克服一些缺点。EV临床使用的一个关键限制是其在体内给药后的不稳定性。实际上,建立“现成的”EV治疗产品的最合理模型是可以稳定储存并在任何时间可以使用的异体EV。尽管关于EV药代动力学和生物分布的研究存在相当大的方法学差异(例如,标记方法、EV来源、注射的EV数量),所有研究都表明,静脉给药后外源性EV的清除是迅速的,半衰期从2分钟到7分钟不等,具体取决于其来源。这与EV迅速定位到肝脏和脾脏等排除器官有关,表明EV被单核吞噬细胞系统捕获。已经探索了各种策略来提高EV在血浆中的稳定性。例如,研究了在EV表面过表达CD47(“别吃我”信号)以避免单核细胞/巨噬细胞的吞噬。然而,这些研究中测试的各种CD47结合策略(生物工程或后期添加到混合颗粒中)仅导致EV半衰期的少量改善。此外,CD47修饰策略存在显著的副作用。例如,外周施用的CD47-EVs模仿红细胞和血小板避免被巨噬细胞/单核细胞摄取的自然过程,会导致循环红细胞减少。另一种生物启发的策略,依赖于通过与EV相关蛋白(CD63/CD9/CD81/LAMP2)融合或通过脂质锚定(如DOPE、胆固醇或神经酰胺)将白蛋白结合域(ABD)结合到EV表面。无论ABD结合策略如何,ABD工程化EV的循环时间与未修饰EV相比显著增加。例如,ABD-CD63 EVs和DOPE-ABD EVs在注射后270分钟和120分钟的血浆稳定性分别提高了10倍和19倍,较未修饰EVs而言。然而,在270分钟后,注射的ABD-CD63 EVs中仍在循环中的不到0.1%。此外,无论修饰策略如何,EV的器官生物分布没有显著变化。使用合成聚合物对EV表面进行稳定化是另一种策略。聚合物涂层最初用于稳定合成纳米载体,如脂质体,通过避免蛋白质包被和被先天免疫细胞摄取,赋予颗粒空间稳定性并延长其在血液中的半衰期。2016年,Kooijmans等人显示,在NeuroA细胞来源的EVs上后插入脂质-PEG改善了它们在血液中的持久性,从而使其循环时间与未修饰EVs相比增加(从10分钟增加到60分钟)。不幸的是,在240分钟后,未观察到天然EV和PEG化EV之间的血浆浓度显著差异。值得注意的是,在240分钟后未观察到肿瘤累积,表明通过增强的通透性和滞留效应缺乏被动EV靶向。相反,Emam等人报告了PEG化肿瘤细胞来源的EVs的肿瘤累积增加,但仅在EVs是从同一小鼠癌细胞系分离并移植到小鼠以产生肿瘤时。例如,在C26细胞肿瘤中,PEG化C26细胞来源的EVs在96小时后仍被检测到,但PEG化B16BL6细胞来源的EVs则没有。这些发现突显了EV稳定化对于维持其与细胞相互作用能力的重要性。一项最新研究表明,与DOPE-ABD-EVs相比,锚定DOPE-PEG分子的EVs在给药后120分钟更快地从血液中清除(分别为19倍对4倍)。与脂质锚定类似,PEG的共价结合以修饰4T1乳腺癌细胞来源的EVs增加了EV的半衰期以及与肿瘤细胞的结合(增加了2倍)。然而,PEG与EV表面蛋白的共价连接可能会影响EV的功能,因为EV表面蛋白是EV特性的关键参与者。此外,单独依赖PEG聚合物来稳定EV(以及纳米载体或蛋白质)是值得怀疑的。现在已经明确,抗PEG的IgG和IgM(它们结合PEG主链或末端甲氧基)在6%至24%的健康个体中存在,这与日常产品(家庭清洁剂、加工食品和化妆品)中PEG的过度使用有关,即使在接触PEG化的纳米药物或治疗蛋白之前。因此,补体激活相关的伪过敏反应(CARPA)综合症在PEG化纳米制剂的系统给药后可能偶尔会被观察到,而它们的不稳定性或加速血液清除(ABC)则更为频繁,可能导致治疗效果不佳。有趣的是,这种现象似乎并不仅限于合成纳米制剂,因为最近也有报道显示PEG化EV的ABC。此外,PEG化还会妨碍靶细胞的相互作用、内吞逃逸以及在生物基质中的扩散,例如肿瘤微环境。因此,需要寻找PEG的替代品。在一些有趣的选择中,聚恶唑啉(polyoxazolines,POx),尤其是聚(2-甲基-2-恶唑啉)和聚(2-乙基-2-恶唑啉)(这类聚合物的两个亲水性成员)展现出良好的生物特性,如细胞和血液相容性、免疫调节和隐身行为。最近,POx作为治疗聚合物在药物递送系统中引起了关注。通过将脂质锚定物嫁接到亲水性POx链上,还可以设计出两亲性POx,形成称为脂质聚恶唑啉(LipoPOx)的脂质聚合物。一些研究表明,使用LipoPOx进行POx化可以延长脂质体的血液循环时间并减少肝脏摄取。因此,在本研究中,研究人员评估了间充质干细胞/基质细胞(MSC)来源的EV的POx化是否影响其固有功能特性的维持(免疫调节、在生物基质中的扩散能力)以及与未修饰EV、PEG化EV(当前“金标准”修饰策略)相比的血浆稳定性和生物分布。结果发现,这种修饰保持并增强了源自MSC的EV的免疫调节特性。研究人员还开发了一种优化的放射性标记方法,以跟踪治疗相关的EV数量(约10的8次方EVs/小鼠)。通过使用放射标记方法在体内追踪EVs,证明了POx化是稳定EVs在血浆中的一种有前景的选择,因为它在注射后6小时内将EV的半衰期提高了6倍。此外,POx化后EV在肿瘤中的累积高于PEG化后。参考文献:Surface modification of extracellular vesicles with polyoxazolines to enhance their plasma stability and tumor accumulation. Biomaterials. 2024 Aug 5;313:122748.外泌体资讯网 Biomaterials丨细胞外囊泡的聚恶唑啉修饰 增强在血浆中的稳定性和肿瘤累积





