膀胱癌(Bladder cancer, BLCA)是全球男性中发病率位居第四的癌症类型。根据临床表现,膀胱癌可分为非肌层浸润性膀胱癌(Non-muscle invasive bladder cancer, NMIBC)和肌层浸润性膀胱癌(Muscle invasive bladder cancer, MIBC)。NMIBC虽然复发率较高,但侵袭性较低,通常不会危及生命,只有约10%-20%的患者会发展为MIBC。而MIBC患者的预后较差,尽管接受了常规治疗,生存率仍然极低。有研究显示,约50%的MIBC患者在术后两年内发生局部复发并伴有远端转移。MIBC常见的转移方式包括淋巴转移和血行转移,最初扩散至盆腔淋巴结,随后通过淋巴管侵及邻近器官,晚期则通过肿瘤新生血管转移至远端器官,导致极高的死亡率。因此,深入了解膀胱癌的转移机制对于恶性膀胱癌的治疗至关重要。
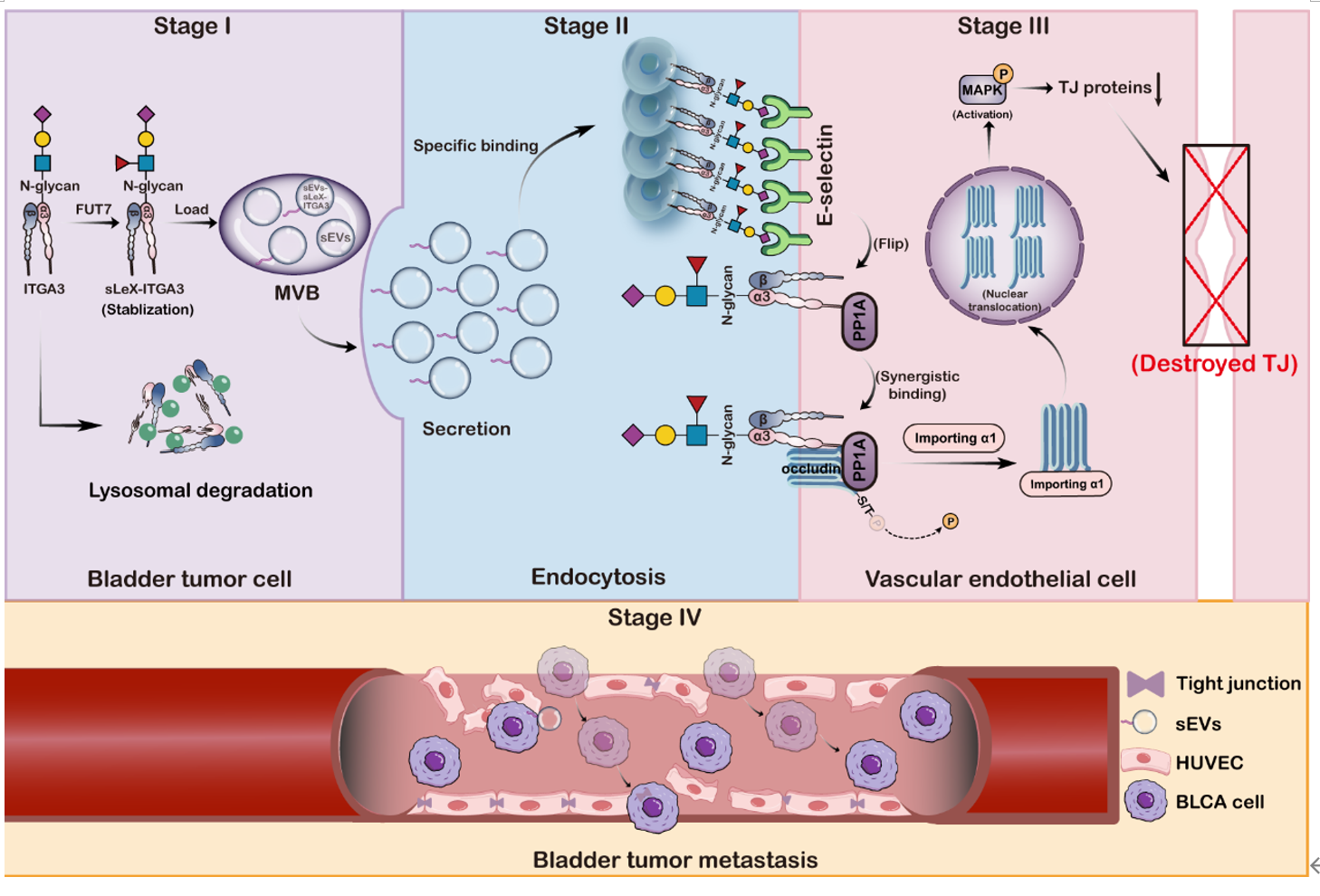
肿瘤微环境中新生血管系统的重塑在肿瘤转移过程中发挥着关键作用。血管通透性的增加对于转移性肿瘤的形成至关重要,随着血管内皮屏障功能的减弱,循环肿瘤细胞能够从血管屏障较为薄弱的部位侵入基质组织,进而引发肿瘤转移。近年来的研究表明,肿瘤细胞分泌的小细胞外囊泡(small extracellular vesicles, sEVs)在介导肿瘤血管系统重塑和肿瘤转移方面具有潜在作用。然而,目前关于糖基化修饰在肿瘤细胞分泌的sEVs中调控肿瘤血管通透性的研究仍然较为有限。唾液酸路易斯寡糖X(Sialyl Lewis X, sLeX)抗原是一种通常位于细胞膜表面糖缀合物上N/O-糖链末端的肿瘤相关寡糖抗原,是糖链发挥异常功能的决定性因素。它由一系列糖基转移酶催化合成,其中α, 1-3 岩藻糖转移酶 VII(α, 1-3 Fucosyltransferase VII, FUT7)催化L-Fuc转移至α, 2-3-唾液酸化乳糖胺链远端的GlcNAc残基上,参与sLeX生物合成最后一个步骤。作为炎症状态下内皮细胞表面E-选择素(E-selectin)的配体,sLeX通过介导靶细胞与内皮细胞之间的粘附,参与了内皮细胞中一系列下游信号的调控。但目前对于sLeX在肿瘤细胞分泌的sEVs中的表达以及是否参与肿瘤血管通透性的调控还尚未可知。近日,西北大学生命科学学院关锋教授团队在国际血管疾病研究学术期刊Angiogenesis(Q1区,IF=9.2)上发表题为“Sialyl Lewis X decorated integrin α3 on small extracellular vesicles promotes metastasis of bladder cancer via enhancing vascular permeability”的论文,主要介绍了sLeX修饰的小细胞外囊泡通过与内皮细胞表面的E-selectin特异性结合,实现高效摄入。sLeX修饰的靶蛋白ITGA3能够协同调控闭合蛋白occludin的磷酸化状态及其核易位,进而增加血管通透性,促进膀胱癌的恶性进展。论文的第一作者是西北大学生命科学学院2023级博士研究生冯慧,西安交通大学第一附属医院泌尿外科梁亮博士为该论文的共同第一作者,西北大学关锋教授为通讯作者。
该研究首先通过数据库挖掘、组织芯片技术及临床血清样本验证,发现sLeX及其关键合成酶FUT7在膀胱癌组织中的表达水平均高于癌旁组织,且二者的表达均与膀胱癌患者发生淋巴血行转移及低存活率显著正相关。随后,通过在体内外实验中过表达或敲低FUT7基因以改变sLeX的表达,结果显示高sLeX修饰水平能够增强膀胱癌细胞的增殖、迁移和克隆形成能力。研究还发现,高表达sLeX的YTS-1细胞通过分泌sEVs抑制人脐静脉内皮细胞(HUVECs)上紧密连接(Tight Junction, TJ)蛋白的表达,增加血管通透性。利用Exo-Tracker荧光探针标记sEVs,发现oeFUT7细胞分泌的sEVs能够提高HUVEC细胞对sEVs的内吞效率,并破坏血管屏障。此外,糖蛋白质组学分析鉴定出sLeX修饰的靶蛋白ITGA3,且sLeX的糖基化修饰通过抑制ITGA3的溶酶体降解途径,从而维持其蛋白的稳定性。作者进一步探讨了ITGA3对血管内皮细胞通透性的影响及其分子调控机制。通过Biotin标记sEVs处理HUVEC细胞,发现sLeX修饰能够增加HUVEC细胞对sEVs中ITGA3的摄入量。多项体内外实验验证了ITGA3通过肿瘤细胞分泌的sEVs传递至HUVEC细胞,破坏血管屏障,诱导肿瘤血管生成,从而推动膀胱癌的转移。具体机制上,通过免疫共沉淀结合质谱分析发现,ITGA3蛋白N265位点的sLeX糖基化修饰协同促进磷酸酶PP1A与闭合蛋白occludin结合,导致occludin在Ser/Thr残基上的去磷酸化。随后,依赖于入核蛋白Importin α1,occludin从细胞膜转移至细胞核,破坏内皮细胞间的紧密连接,增加血管通透性,并诱导肿瘤血管新生,进而推动膀胱癌的恶性发展。该研究为转移性膀胱癌的临床治疗提供了新的理论依据和潜在的治疗靶点。
参考文献:Sialyl Lewis X decorated integrin α3 on small extracellular vesicles promotes metastasis of bladder cancer via enhancing vascular permeability, Angiogenesis. 2024 Sep 2:1-9. doi: 10.1007/s10456-024-09947-3.
外泌体资讯网 Angiogenesis|西北大学关锋教授团队:小细胞外囊泡上sLeX糖基化修饰参与破坏血管完整性促进肿瘤细胞转移的分子机制





