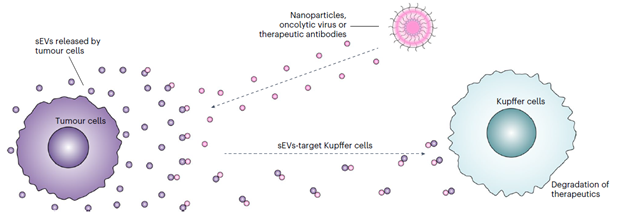
2024年9月2日,Nature Materials杂志在线发表了题为Tumour-derived small extracellular vesicles act as a barrier to therapeutic nanoparticle delivery的研究论文。该研究挑战了传统观点,首次揭示了肿瘤细胞分泌的外泌体作为一种新发现的生物学屏障,在肿瘤抵抗治疗性药物方面充当了“主动防御系统”的关键角色。这些外泌体能够结合靶向肿瘤的多种治疗性药物,使治疗性药物偏离肿瘤区域,并被外泌体转运至肝脏中的Kupffer细胞进行降解,从而大大削弱了药物在肿瘤中的累积和治疗效果(图1)图1. 肿瘤细胞分泌小型细胞外囊泡(sEVs)介导的“防御系统”机制示意图纳米颗粒药物递送系统已在临床中广泛应用,但面临的一个核心问题是如何将足够量的纳米颗粒有效递送至肿瘤部位,以实现理想的治疗效果。尽管已有多种策略,包括优化纳米颗粒的尺寸、形状和表面化学性质,以及通过增强通透性和滞留效应(EPR效应)或配体靶向机制来提高纳米颗粒在肿瘤中的累积,然而,研究发现,最终只有及其微量的静脉注射纳米颗粒能够成功到达并积累于实体肿瘤中。这一低效率极大地限制了纳米颗粒在肿瘤治疗中的应用潜力。近年来,研究者开始关注肿瘤微环境中的某些特征,如密集的细胞外基质、实体应力和异常的血管结构等,这些特征对纳米颗粒在肿瘤中的累积产生了重要影响。尽管科学家们为克服这些障碍做出了巨大努力,但进展依然十分有限,主要原因是药物递送至肿瘤组织的机制仍存在许多未知之处。sEVs是一类由细胞分泌的小型囊泡,广泛存在于包括肿瘤在内的多种组织环境中。研究表明,肿瘤细胞是sEVs的主要来源之一,且这些sEVs在肿瘤微环境中的浓度通常高于健康组织,然而,肿瘤部位高浓度外泌体的物理化学意义却被长期被忽略。该论文通过一系列实验,揭示了肿瘤来源的sEVs如何阻碍纳米颗粒在肿瘤组织中的累积。首先,研究者在小鼠模型中验证了这一假设。通过CRISPR-Cas9技术敲除Rab27a基因,研究表明,Rab27a基因的敲除显著减少了小鼠肿瘤细胞中sEVs的分泌,直接导致纳米颗粒在肿瘤中的累积量大幅增加。此外,实验还发现,敲除Rab27a基因不仅减少了sEVs在肝脏Kupffer细胞中的累积,也增加了纳米颗粒在肿瘤细胞和肿瘤浸润免疫细胞中的摄取。该研究的一个关键发现是,sEVs可以与纳米颗粒结合,并通过物理作用(如范德华力)将其转运至肝脏的Kupffer细胞进行降解,从而削弱纳米颗粒在肿瘤中的累积。研究者观察到,sEVs与纳米颗粒的结合会导致复合物的尺寸增大,可能进一步影响其在肿瘤中的渗透性和累积效果。然而,实验结果显示,sEVs对纳米颗粒摄取的抑制作用不仅仅由于尺寸增大,还包括上述分子层面的作用。例如:通过使用抗体阻断sEVs表面的黏附分子ICAM-1,研究者进一步证实了ICAM-1在sEVs与纳米颗粒相互作用及其转运至Kupffer细胞中的重要性,这种分子机制的存在,也显示出了肿瘤抵抗治疗策略的主动性。接下来,研究人员探讨了通过抑制sEVs的分泌,或许可以减少与纳米颗粒结合sEVs的水平,并可能显著提高纳米颗粒的递送效率,从而增强其在肿瘤治疗中的应用效果。值得注意的是,研究者提出,将Rab27a敲除与治疗性mRNA(如Pten或Sting mRNA)的共递送策略相结合,这在小鼠模型中显示出显著的抗肿瘤效果,且未引发明显的器官毒性。研究人员还进一步探讨了sEVs屏障效应在其他治疗方法中的适用性。结果显示,sEVs不仅对有机纳米颗粒(如脂质体、PLGA纳米颗粒)有阻碍作用,还对无机纳米颗粒(如金纳米颗粒、二氧化硅纳米颗粒)及其他肿瘤疗法(如溶瘤病毒疗法和抗体疗法)产生显著影响。这一发现进一步扩大了sEVs作为治疗性屏障的应用范围,表明通过针对sEVs的靶向治疗可能是提高多种肿瘤治疗效果的有效策略。总的来说,这篇论文通过详实的实验和深入的机制分析,揭示了肿瘤来源的sEVs如何对纳米颗粒的递送形成阻碍,提出了通过干扰这一屏障来提高纳米颗粒肿瘤治疗效果的潜在策略。这项研究不仅丰富了我们对肿瘤微环境中sEVs作用的理解,还为未来的纳米药物开发提供了新的思路。该项研究对于肿瘤的各类治疗方法具有里程碑意义,未来的研究可能会进一步探讨如何有效克服这一sEVs屏障,并探索sEVs在其他类型肿瘤中的作用及其与其他治疗方法的相互作用,从而推动肿瘤治疗的成功。该研究第一作者为前宾夕法尼亚大学博士后,现中国科学技术大学宫宁强教授,宾夕法尼亚大学钟文群研究型助理教授和Mohamad-Gabriel Alameh教授。宾夕法尼亚大学Michael J. Mitchell教授、Wei Guo教授与2023年诺贝尔生理学或医学奖得主Drew Weissman教授为该论文的共同通讯作者。外泌体资讯网 诺奖团队Nature子刊里程碑式发现:肿瘤来源的小型细胞外囊泡是抵抗药物递送的屏障