关节软骨由于其独特的结构在受伤后进行自我修复的能力有限,随着疾病的进展往往会发展成骨关节炎。目前基于无细胞策略在软骨组织工程中的应用方兴未艾,但是如何进一步增强其治疗效果称为再生医学的前沿问题。近日,解放军总医院骨科医学部郭全义教授、刘舒云副教授团队、中山大学第一附属医院郭维民团队和北大口腔医院牛宇霆教授团队在Journal of Nanobiotechnology上发表题为“Apoptotic extracellular vesicles derivedfrom hypoxia-preconditioned mesenchymal stem cells within a modified gelatine hydrogel promote osteochondral regeneration by enhancing stem cell activity and regulating immunity”的文章(2024 Feb 23;22(1):74),该研究一方面揭示了低氧预适应脂肪间充质干细胞来源的凋亡囊泡通过增强BMSC成软骨分化以及调节免疫微环境的软骨修复策略,另一方面结合了基于改性明胶的水凝胶以及分级多孔ECM支架作为凋亡囊泡递送系统,共同促进关节软骨的损伤修复。贵州医科大学硕士研究生丁振罡、华中科技大学博士研究生严子能和贵州医科大学硕士研究生袁勋共同第一作者。解放军总医院骨科医学部郭全义教授、刘舒云副教授、中山大学第一附属医院郭维民和北大口腔医院牛宇霆教授为共同通讯作者。
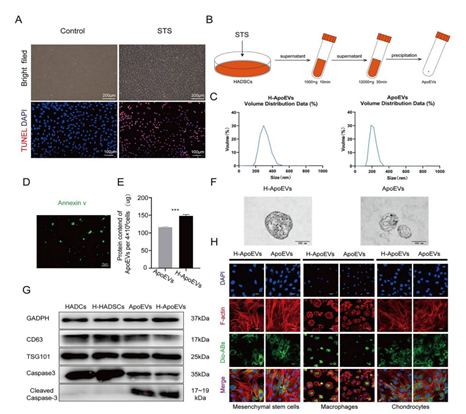
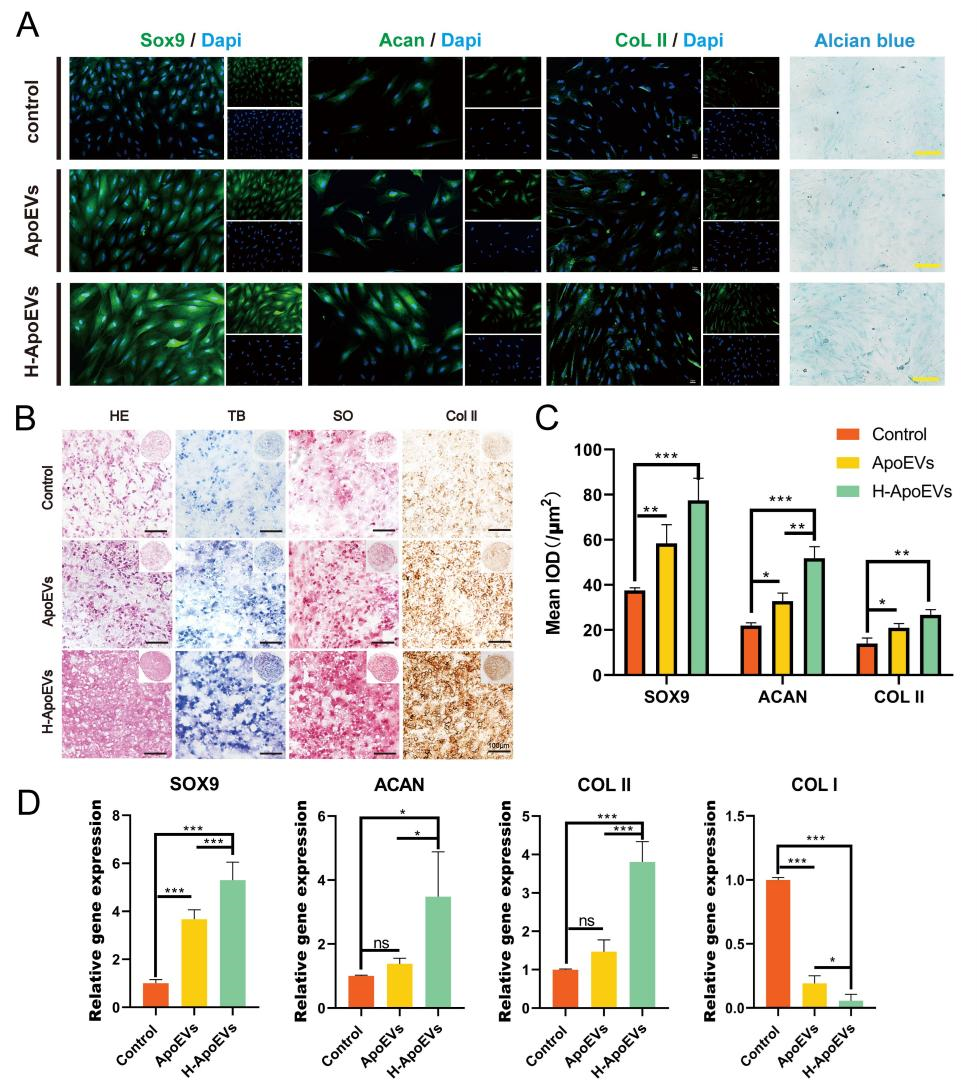
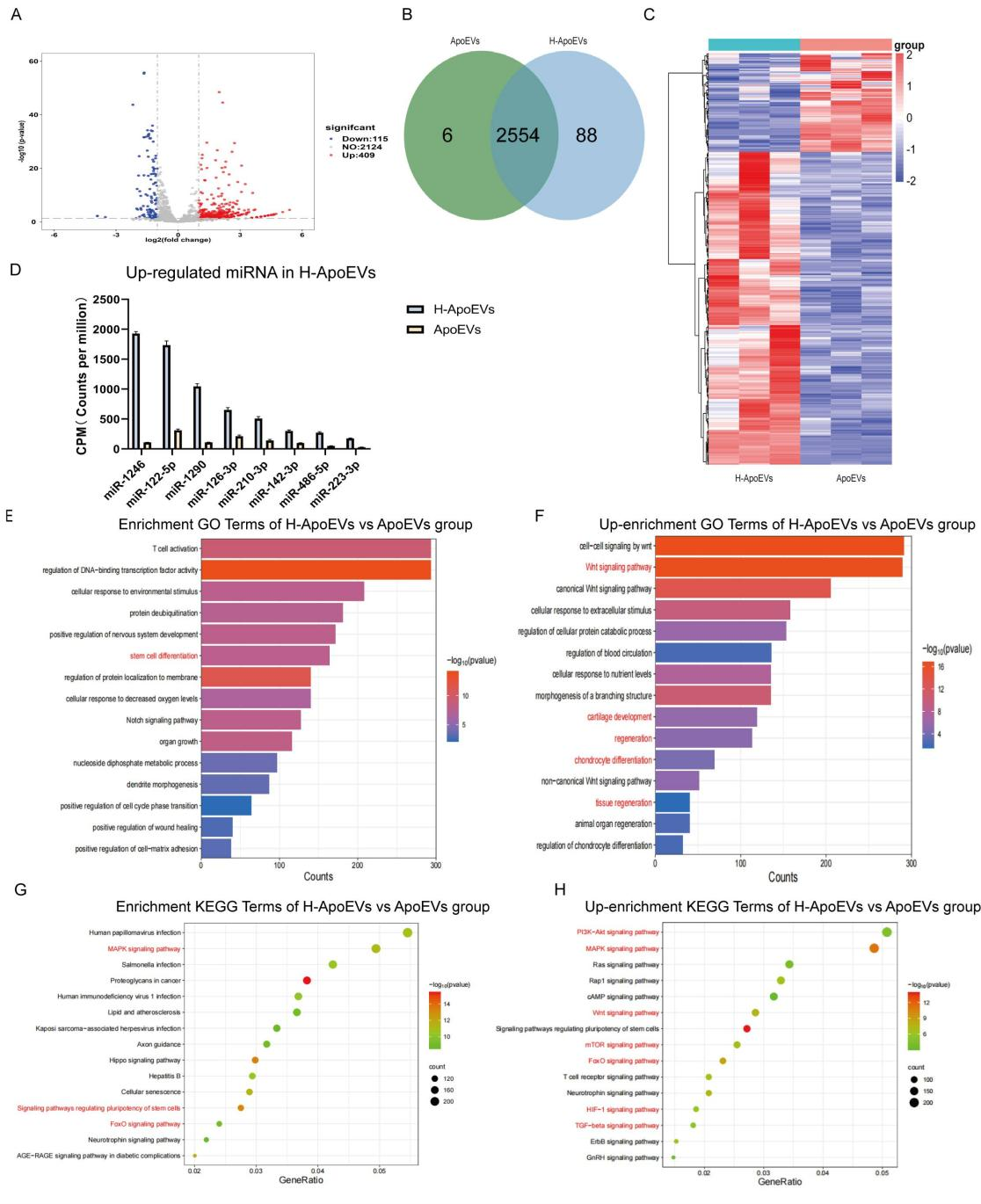
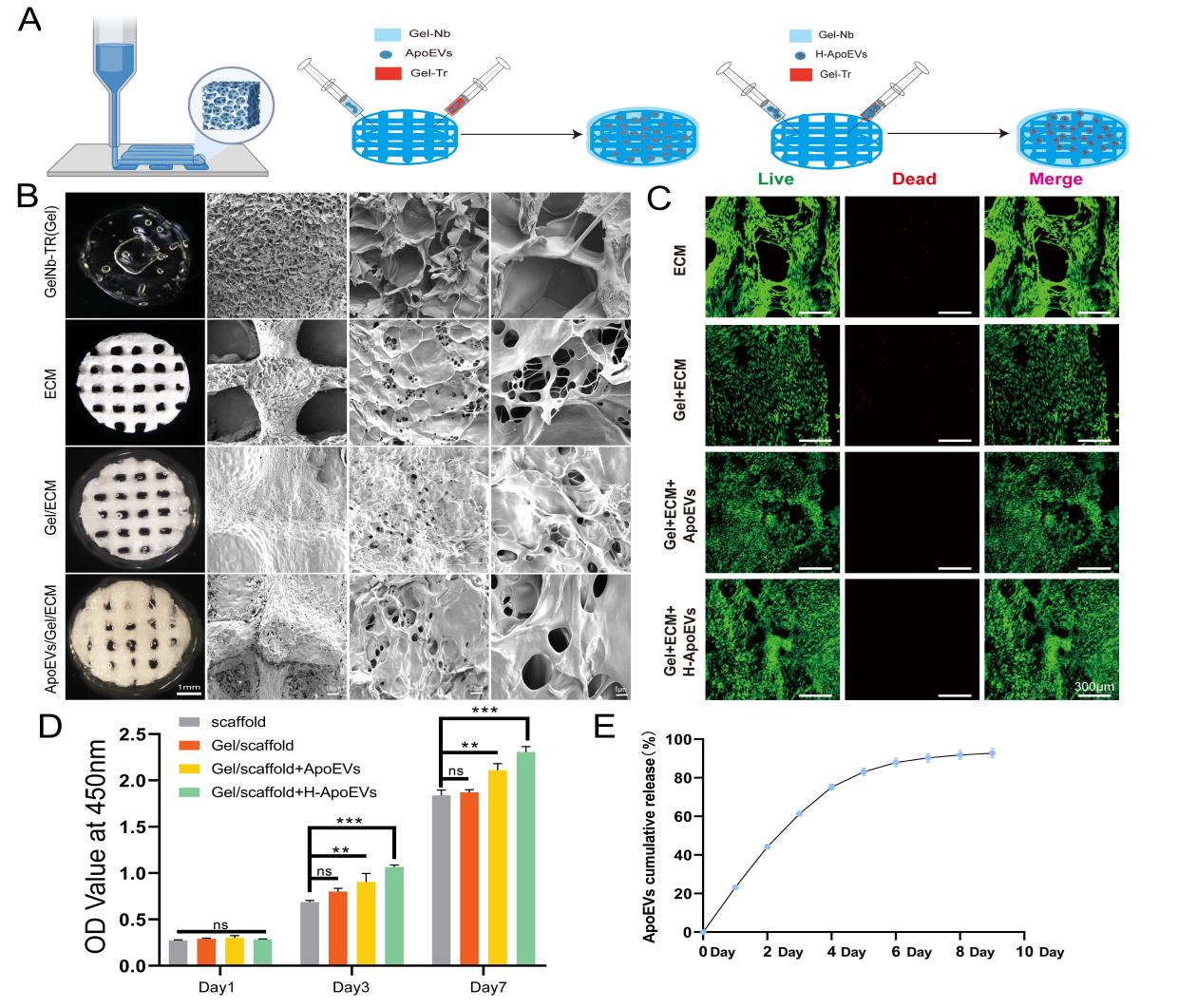
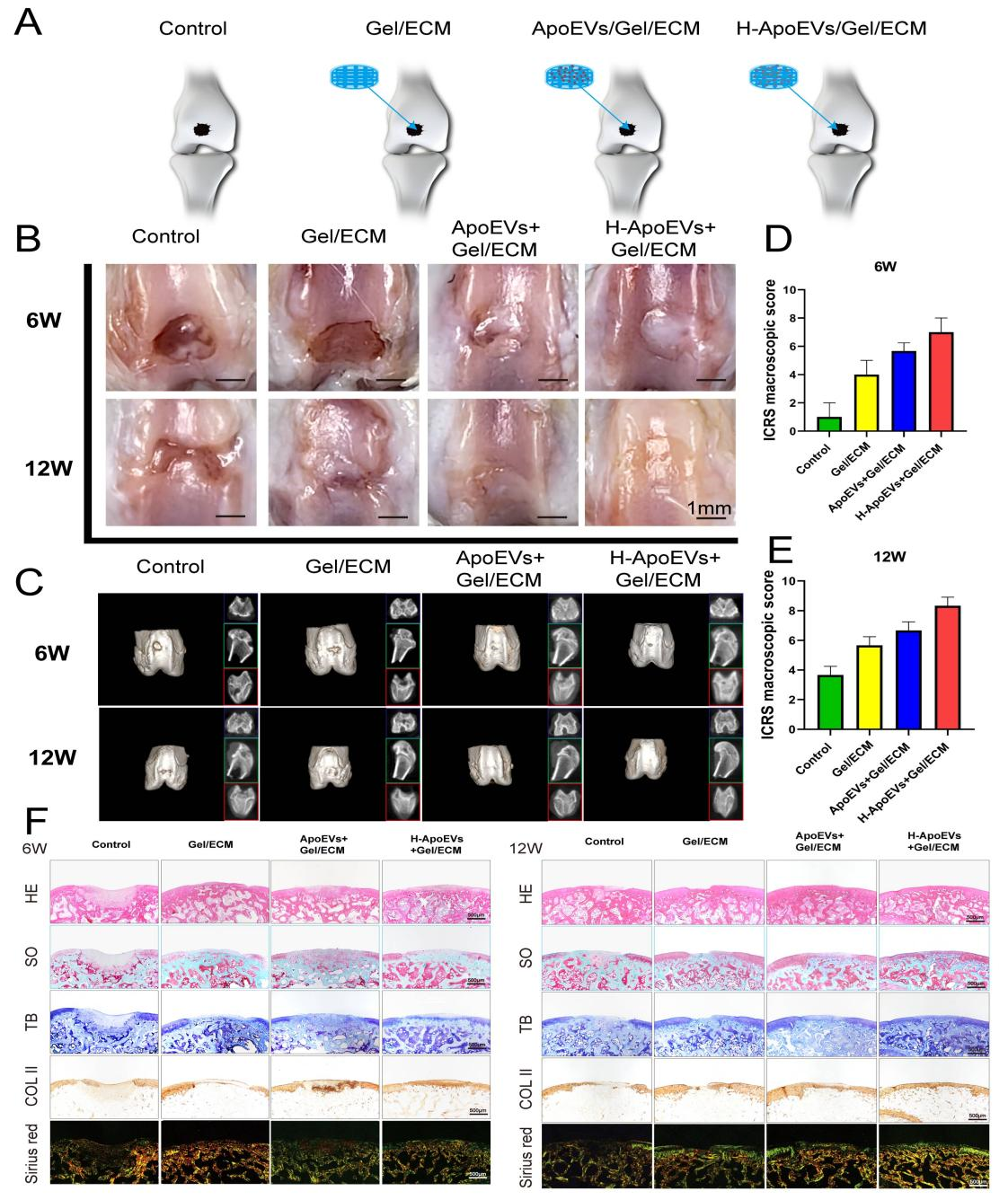
最近的一系列研究表明,干细胞移植后在体内大都会发生凋亡,随后产生的凋亡囊泡(ApoEVs) 在疾病治愈中起着至关重要的作用。此外,已知体内生理环境中间充质干细胞(MSC)存在于相对低氧条件下,低氧环境可以改变 MSC 的功能和分泌特性。这项研究旨在探讨从低氧条件下脂肪间充质干细胞来源的凋亡囊泡(H-ApoEVs)是否比从常氧条件下培养的细胞中提取的 ApoEVs 对软骨修复产生更大的意义。通过体外细胞实验,研究者证明与 ApoEVs 相比,H-ApoEVs 对干细胞成软骨分化和骨髓巨噬细胞(BMDM)的M2极化有更强的影响。此外,利用改良的明胶基质/3D 打印的细胞外基质(ECM)支架复合物作为载体,作者将 H-ApoEVs 输送到关节腔中,从而建立软骨再生系统。总之,这项研究证实,基于低氧预处理增强了干细胞衍生的 ApoEVs 的功能以及改良明胶基质/3D 打印 ECM 支架的 H-ApoEVs 递送系统,代表了一种有前景的促进软骨再生的方法。(A)用 STS 处理的细胞的形态学变化和 TUNEL 染色结果。在正常条件下培养的细胞作为对照。(B)通过梯度离心制备凋亡囊泡的过程示意图。(C)H-ApoEVs 和 ApoEVs 的NTA结果。(D)ApoEVs 的 Annexin V 染色的图像。(E)采用 BCA 法测定两组 ApoEVs 的蛋白浓度。(F)TEM 观察两种 ApoEVs 的结构。(G) CD63、TSG101、Caspase-3 和Cleaved- Caspase-3 表达的 Western 印迹分析。(H) 骨髓间充质干细胞、骨髓来源的巨噬细胞和软骨细胞对 DiO 标记的 ApoEVs 和H-ApoEVs 的摄取。首先,在常氧和低氧条件下培养脂肪间充质干细胞并添加 STS (星形孢菌素) 诱导其细胞凋亡。使用 TEM、western blotting和纳米颗粒跟踪分析 (NTA) 对 ApoEVs 和 H-ApoEVs 进行了表征。值得注意的是,NTA 显示 ApoEVs 的平均直径为 205.6 nm,而 H-ApoEVs 的平均直径为 298.2 nm,表明 H-ApoEVs 的尺寸略有增加;这些结果表明,H-ApoEV 可能携带更多的囊泡内容物(图1 C)。并且两种类型的 ApoEVs 都被骨髓间充质干细胞、巨噬细胞和软骨细胞成功摄取。通过组织染色、免疫组织化学染色和软骨生成相关基因表达分析,作者证实 H-ApoEVs和ApoEVs 都可以通过上调胶原蛋白和蛋白聚糖的表达来促进 BMSCs的软骨形成分化,并且H-ApoEVs对BMSC软骨形成分化的影响更显著(图2)。图2评估用不同ApoEVs 处理的 BMSCs 的软骨形成分化(A)不同 ApoEVs 处理的BMSC 中 SOX9 、 Acan 和 COL II 免疫荧光染色以及阿利新蓝染色的图像。(B)与不同 ApoEVs 共孵育的 BMSC 颗粒中胶原蛋白 II 的 H&E、甲苯胺蓝和番红-O 染色结果。(C) BMSCs中 SOX9、Acan 和 COL II 免疫荧光染色的定量分析。(D) 不同 ApoEV 培养的BMSCs 中透明软骨(SOX9、Acan 和 COL II)/纤维软骨 (COL I) 标志物表达的 qPCR 分析。研究表明,M2巨噬细胞有助于组织修复和抗炎。作者评估了ApoEVs和H-ApoEVs对大鼠骨髓来源巨噬细胞极化的影响。免疫荧光染色结果显示,ApoEVs降低CD86表达、增加CD206表达,并且H-ApoEVs在抑制炎症方面更有效(图3A、B)。H-ApoEVs治疗组的M2相关基因表达显著增加,而M1相关基因表达显著降低(图3D)。流式细胞术分析显示也有同样的趋势。此外流式细胞术和TUNEL染色显示H-ApoEVs的对于炎症环境下软骨细胞抗凋亡效果略强于ApoEVs。总体结果表明,ApoEVs和H-ApoEVs通过诱导M2巨噬细胞极化调节炎症环境并促进组织再生,且H-ApoEVs效果优于ApoEVs。(A)用不同ApoEVs 处理的 BMDM 中 CD86 和 CD206 的免疫荧光染色。(C) 流式细胞术结果:CD86(+) 或 CD163(+) BMDM 的百分比。(B) 滑膜组织中 M2 巨噬细胞表面标志物 (CD206) 和 M1 巨噬细胞表面标志物 (CD86) 的免疫荧光染色。(D) qPCR 分析不同 ApoEVs 处理的 BMDMs 中 M1 型以及M2型基因表达。(E、F) BMDM和滑膜组织中 CD206 和 CD86 免疫荧光染色的定量分析。(J)不同条件下共培养后软骨细胞的流式细胞术分析。(G)不同组中凋亡细胞的百分比 。(H、I)用不同ApoEVs 处理的软骨细胞的 TUNEL 染色图像。TUNEL染色的定量分析。随后对ApoEVs和H-ApoEVs中miRNA进行了测序分析。H-ApoEVs的409种miRNA表达较高,而115种miRNA表达较低。在总计2648种miRNA中,88种在H-ApoEVs中特异的,6种在ApoEVs中独有的(图4B)。表明低氧条件下的H-ApoEVs含有更多miRNA并具有更强生物活性。对miRNA的GO富集分析显示,它们参与“软骨发育”、“软骨细胞分化”、“再生”等生物过程。KEGG富集分析表明,这些miRNA参与到干细胞软骨形成相关的“PI3K-Akt信号通路”、“FoxO信号通路”和“TGF-β信号通路”(图4)。图4 ApoEVs 和H-ApoEVs 中的 miRNAs 测序结果(A-C)两种 ApoEVs 之间 miRNA 的火山图、venn图和热图。(E、G)不同 miRNAs 的 GO 富集分析和KEGG 通路富集分析。(D)H-ApoEVs 中上调 miRNA 的定量呈现。(F、H)与 ApoEVs 相比H-ApoEVs 中上调的 miRNA 的 GO 富集分析和KEGG 通路富集分析。改性明胶水凝胶与分级多孔ECM支架共同组成的ApoEVs缓释体系。死活染色以及CCK-8实验显示该复合支架具有良好的生物相容性(图5),同时具有较好的缓释性能。图5 负载有 ApoEVs 或 H-ApoEVs 和ApoEVs 释放的 Gel/ECM 复合支架的制备和表征(A)负载 ApoEVs 或 H-ApoEVs 的Gel/ECM 复合支架的制备示意图。(B) GelNb-TR、ECM、Gel/ECM 和负载有ApoEVs的Gel/ECM 复合支架的宏观和扫描电镜图像。(C、D)不同组分支架的活/死染色以及CCK-8结果。(E)载有ApoEVs的Gel/ECM 复合支架中 ApoEVs 释放的 BCA 测定结果。(A)体内实验分组示意图。(B) 6 周和 12 周时修复组织的宏观图像。(C) 修复软骨的 2D 和 3D micro-CT 图像。(D、E)修复软骨的 ICRS 视觉组织学评估。(F) 修复组织病理学染色结果。近年来,基于细胞、支架和生物活性因子三要素的组织工程策略在软骨再生领域得到了广泛的研究。对于细胞以及细胞衍生物进行了系统的研究,然而大多数细胞的体外培养并不符合其体内生理性氧浓度。先前对于细胞的低氧培养结果表明在5%氧气浓度下可以增强脂肪间充质干细胞的成软骨分化效果,作者随后提取常氧与低氧条件下培养细胞并提取凋亡囊泡进行研究。结果表明低氧与处理后间充质干细胞来源的凋亡囊泡可以增强BMSC成软骨分化效果。此外miRNA测序结果显示相比于ApoEVs,在H-ApoEVs中miR-1246的上调最高,而先前研究表明miR-1246 可以增强巨噬细胞的M2型极化,这与体外结果一致。表明在其体内生理氧分压下细胞产生的凋亡囊泡富含更多的生物活性成分,具有更强的治疗效果。随后进一步体内实验结果显示6周时,对照组骨软骨缺损明显,只有少量肉芽组织。支架组、ApoEVs/支架组和H-ApoEVs/支架组的修复显著优于对照组,但组织仍较薄且表面不平整。ApoEVs/支架组的组织大多填充了缺损区,但新生成组织与正常软骨间表面和边界不平整。12周时,对照组的修复程度提高,但软骨与正常组织差异明显。支架组组织多,但修复效果不佳。ApoEVs/支架组填充了大部分缺损,但新生成组织和正常软骨间仍有边界。H-ApoEVs/支架组的组织填充理想,颜色接近正常软骨。ICRS评分显示H-ApoEVs/支架组在6周和12周时软骨修复明显优于其他组(图6)。此外,H&E染色、天狼星红染色、番红O-固绿染色、甲苯胺蓝染色和II型胶原免疫组化染色显示在6周时,对照组修复区域与正常组织边界清晰但不均匀。H-ApoEVs/支架组修复区域大部分与正常组织融合,修复组织厚度不及正常软骨。12周时,支架组的胶原蛋白和糖胺聚糖含量较对照组有所提高,但表面不均匀;ApoEVs/支架组修复区域平整度和边缘融合程度优于支架组和对照组,但糖胺聚糖和胶原蛋白表达低于正常软骨。H-ApoEVs/支架组的修复区域与正常组织相似,软骨细胞排列规则,糖胺聚糖和II型胶原的表达显著增加(图6F)。这些结果表明,H-ApoEVs/Gel/ECM复合支架在软骨再生中具有治疗价值。总之,该研究创新性的结合了低氧策略与凋亡囊泡结合的方式对软骨修复进行探索,强调了低氧预处理对于间充质干细胞产生的凋亡囊泡治疗效果的提高作用。最后结合改性明胶与ECM支架构成的缓释系统,为软骨修复提供了新的策略。Apoptotic extracellular vesicles derived from hypoxia-preconditioned mesenchymal stem cells within a modified gelatine hydrogel promote osteochondral regeneration by enhancing stem cell activity and regulating immunity,J Nanobiotechnology. 2024 Feb 23;22(1):74. doi: 10.1186/s12951-024-02333-7.外泌体资讯网 J Nanobiotechnology|解放军总医院郭全义/中山附一院郭维民:低氧预处理MSCs 来源的凋亡囊泡促进骨软骨修复