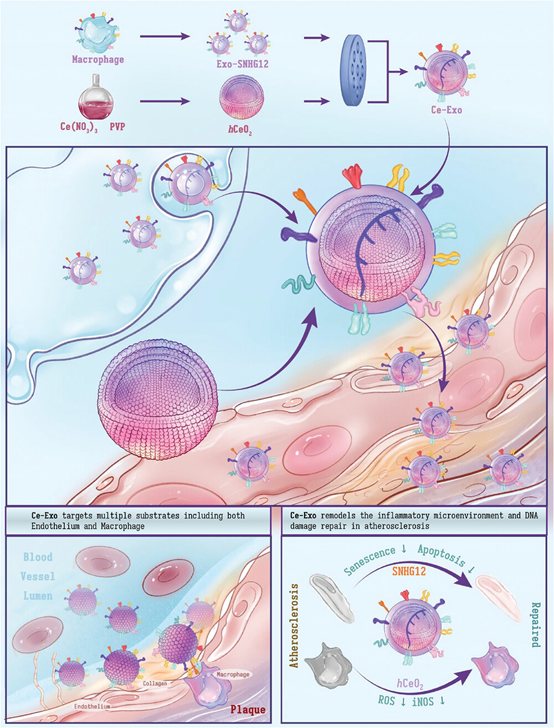
动脉粥样硬化作为急性心肌梗死的始动环节,是造成急性心血管事件的主要原因。其被认为是一种脂蛋白驱动的慢性炎性疾病,表现出了以广泛基因组不稳定为代表的肿瘤样特征。然而,目前针对性的以动脉粥样硬化的免疫微环境改变及DNA 损伤为靶点的治疗策略仍然缺乏,严重限制了动脉粥样硬化治疗药物的疗效。有鉴于此,上海交通大学医学院附属第六人民医院急诊医学科傅一牧团队在Small杂志上发表题为 “Gene-Engineered Cerium-Exosomes Mediate Atherosclerosis Therapy Through Remodeling of the Inflammatory Microenvironment and DNA Damage Repair”的论文(2024 Sep 5:e2404463),主要介绍了一种用于靶向动脉粥样硬化斑块以重塑局部免疫微环境并修复 DNA 损伤的载铈基因工程化SNHG12巨噬细胞外泌体(Ce-Exo)。上海交通大学医学院附属第六人民医院心内科魏鹏,急诊医学科王一帆及上海中医药大学冯海燕为文章共同第一作者。上海交通大学医学院附属第六人民医院急诊医学科傅一牧,骨科钱宇轩,超声医学科姜礼贤与放射科张强为文章共同通讯作者。
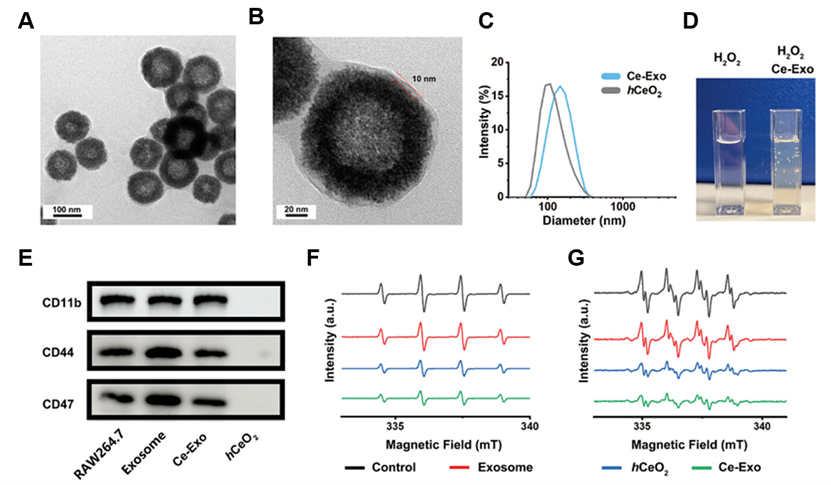
在这项研究中,作者团队通过基因工程改造了巨噬细胞,使其分泌携带SNHG12基因序列的外泌体作为lncRNA递送平台,并通过装载空心氧化铈纳米颗粒(hCeO2)构建了铈-巨噬细胞外泌体(Ce-Exo)。体内和体外实验证明,Ce-Exo通过巨噬细胞遗传的膜蛋白将负载的lncRNA SNHG12和hCeO2靶向到动脉粥样硬化部位。此外,Ce-Exo 中装载的 hCeO2 和 SNHG12 表现出协同效应,可改善炎症微环境并促进内皮细胞的 DNA 修复,从而有效延缓动脉粥样硬化的进展。图1. Ce-Exo 的制备及对于动脉粥样硬化应用的示意图图2. Ce-Exo纳米复合物的表征及其多种模拟酶活性的评估\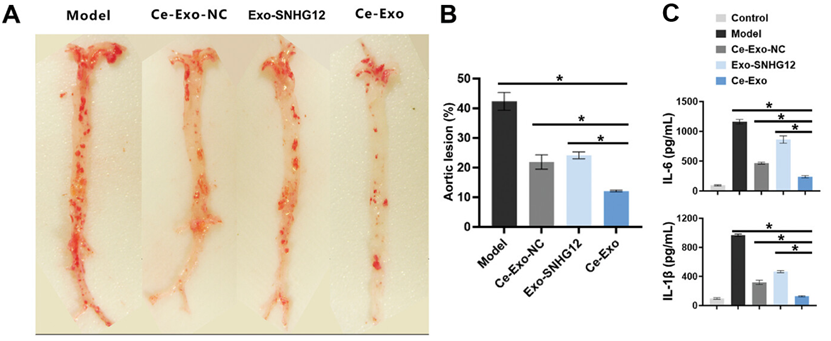 图3. Ce-Exo 对动脉粥样硬化小鼠的治疗效果该研究介绍了经过基因工程改造的巨噬细胞外泌体的仿生纳米药物,这些表达了lncRNA SNHG12的外泌体负载了hCeO2,可提高对动脉粥样硬化的疗效。SNHG12的过表达通过限制DNA损伤和延缓细胞衰老改善了对内皮细胞的保护。hCeO2 的引入还赋予了 Ce-Exo 多酶活性和显著的 ROS 清除能力,从而使其能够成功调控巨噬细胞并迅速重塑复杂的免疫微环境。融合后的纳米药物Ce-Exo继承了巨噬细胞外泌体的膜成分,表现出卓越的多价靶向功能,并优先在动脉粥样硬化斑块中积累和深入渗透,从而提高了在动脉粥样硬化小鼠模型中的疗效。总之,Ce-Exo 能够靶向动脉粥样硬化斑块,通过重塑免疫微环境修复内皮细胞DNA损伤,最终有效缓解动脉粥样硬化。纳米技术与分子生物学的融合为开发靶向、高效、多元的治疗药物开辟了新途径,从而为心血管疾病患者带来了新希望。Wei P, Wang Y, Feng H, Zhang F, Ji Z, Zhang K, Zhang Q, Jiang L, Qian Y, Fu Y. Gene-Engineered Cerium-Exosomes Mediate Atherosclerosis Therapy Through Remodeling of the Inflammatory Microenvironment and DNA Damage Repair. Small. 2024 Sep 5:e2404463. doi: 10.1002/smll.202404463. Epub ahead of print. PMID: 39235409.
图3. Ce-Exo 对动脉粥样硬化小鼠的治疗效果该研究介绍了经过基因工程改造的巨噬细胞外泌体的仿生纳米药物,这些表达了lncRNA SNHG12的外泌体负载了hCeO2,可提高对动脉粥样硬化的疗效。SNHG12的过表达通过限制DNA损伤和延缓细胞衰老改善了对内皮细胞的保护。hCeO2 的引入还赋予了 Ce-Exo 多酶活性和显著的 ROS 清除能力,从而使其能够成功调控巨噬细胞并迅速重塑复杂的免疫微环境。融合后的纳米药物Ce-Exo继承了巨噬细胞外泌体的膜成分,表现出卓越的多价靶向功能,并优先在动脉粥样硬化斑块中积累和深入渗透,从而提高了在动脉粥样硬化小鼠模型中的疗效。总之,Ce-Exo 能够靶向动脉粥样硬化斑块,通过重塑免疫微环境修复内皮细胞DNA损伤,最终有效缓解动脉粥样硬化。纳米技术与分子生物学的融合为开发靶向、高效、多元的治疗药物开辟了新途径,从而为心血管疾病患者带来了新希望。Wei P, Wang Y, Feng H, Zhang F, Ji Z, Zhang K, Zhang Q, Jiang L, Qian Y, Fu Y. Gene-Engineered Cerium-Exosomes Mediate Atherosclerosis Therapy Through Remodeling of the Inflammatory Microenvironment and DNA Damage Repair. Small. 2024 Sep 5:e2404463. doi: 10.1002/smll.202404463. Epub ahead of print. PMID: 39235409.外泌体资讯网 Small|上海交通大学傅一牧团队:基因工程化铈外泌体通过重塑免疫微环境和修复 DNA 损伤治疗动脉粥样硬化