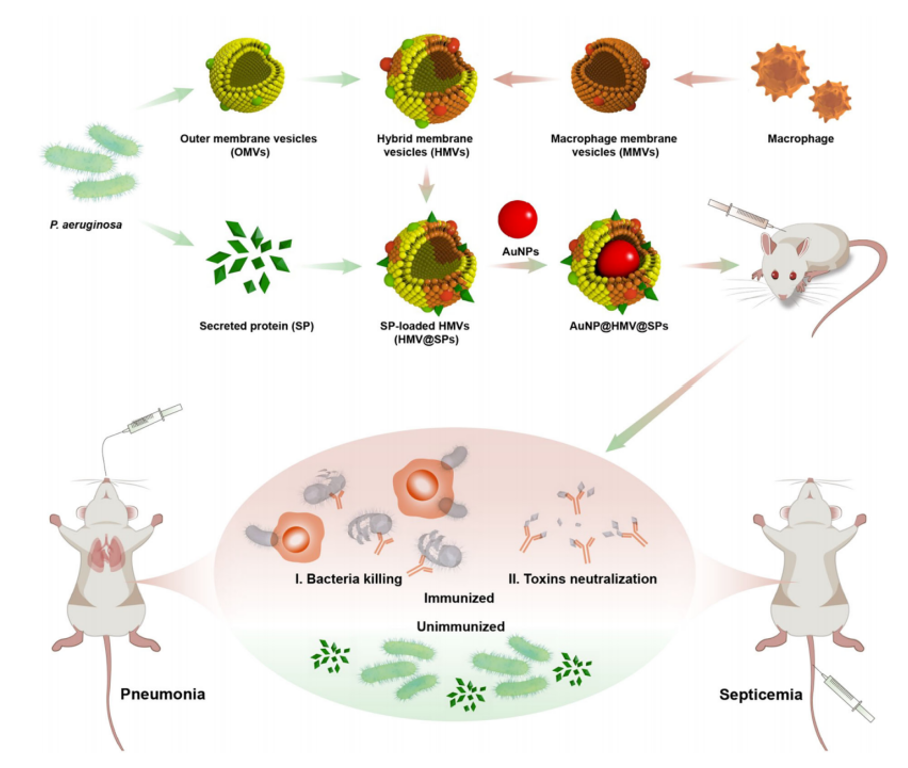
细菌感染,尤其是由多重耐药菌引起的感染,已经成为全球公共健康的严峻挑战。尽管疫苗在抗击感染方面发挥着关键作用,但针对临床常见的细菌感染,如由铜绿假单胞菌(Pseudomonas aeruginosa)引起的感染,目前尚无可临床使用的疫苗。疫苗研发的一个重要挑战是铜绿假单胞菌等细菌能产生多种毒力因子来实现对宿主的侵袭和感染,开发针对多种毒力因子具有保护效力的多抗原疫苗尤为关键。
近日,中山大学丁鑫团队在前期细菌外膜囊泡药物递送系统的研究基础上(Science Advances 2024, 10, eadk9754;Advanced Healthcare Materials 2024, 13, 2304477;Advanced Functional Materials 2021, 31, 2103442),报道了一种基于细菌和巨噬细胞杂化膜囊泡的多抗原纳米疫苗,成功预防铜绿假单胞菌的感染。论文以“A multiantigenic antibacterial nanovaccine utilizing hybrid membrane vesicles for combating Pseudomonas aeruginosa infections”为题发表在国际细胞外囊泡学会(ISEV)官方期刊Journal of Extracellular Vesicles(2024,13(10):e12524)。中山大学丁鑫副教授为该论文的通讯作者,2023级博士研究生彭心然为该论文的第一作者。
这项研究通过将来自铜绿假单胞菌的外膜囊泡和巨噬细胞的膜囊泡进行融合获得杂化膜囊泡(HMVs),表面再吸附铜绿假单胞菌分泌的游离外毒素(SP),然后将杂化膜包覆在佐剂纳米金(AuNPs)表面。该设计改善了递送铜绿假单胞菌多种毒力因子的策略存在的毒性问题,且维持了多种毒力因子的免疫原性。另外联合免疫佐剂,获得了免疫作用增强的抗菌疫苗。
图1 杂化膜抗菌纳米疫苗的设计示意图
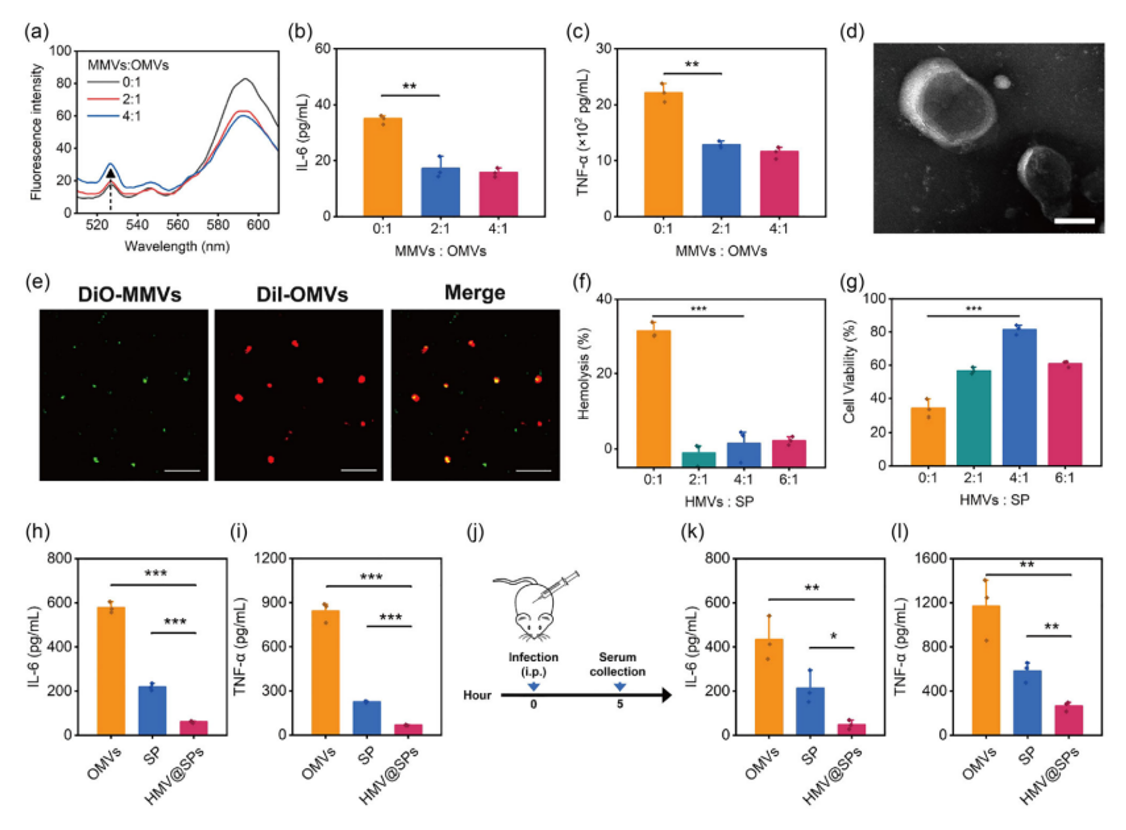
图2 杂化膜囊泡对毒力因子的减毒作用作者将巨噬细胞膜囊泡与铜绿假单胞菌外膜囊泡融合,不仅改善了细菌外膜囊泡的毒性,而且能吸附来自铜绿假单胞菌分泌的外毒素,并改善外毒素的溶血性与细胞毒性。吸附了外毒素的杂化膜囊泡HMV@SPs在小鼠体内表现出显著降低的炎症反应,由此说明它比铜绿假单胞菌外膜囊泡和分泌的毒素具有更好的生物安全性。

图3 杂化膜囊泡疫苗对菌血症的预防作用HMV@SPs联合纳米金佐剂的疫苗AuNP@HMV@SPs在铜绿假单胞菌诱导的菌血症小鼠模型中显示出了优异的细菌清除效果与最高的小鼠生存率。此外,该疫苗也降低了菌血症中的血液炎症因子水平,并缓解了铜绿假单胞菌感染造成的组织损伤。此疫苗在肺部感染动物模型中也表现出优异的预防作用,能降低超过99.9%的细菌负荷。这一研究不仅突显了AuNP@HMV@SPs作为一种安全有效的抗菌纳米疫苗的潜力,更为开发针对多重耐药病原体的多抗原抗菌疫苗提供了新的平台。随着耐药细菌感染问题的加剧,找到新型疫苗解决方案变得尤为重要。我们期待这一研究能够为抗菌疫苗研发提供新思路,助力公共健康事业的发展。参考文献:X. Peng, Y. Luo, L. Yang, Y.Y. Yang, P. Yuan, X. Chen, G.B. Tian, X. Ding, A multiantigenic antibacterial nanovaccine utilizing hybrid membrane vesicles for combating Pseudomonas aeruginosa infections, Journal of Extracellular Vesicles 2024, 13, e12524.原文链接:https://isevjournals.onlinelibrary.wiley.com/doi/10.1002/jev2.12524