胶质母细胞瘤(Glioblastoma,GBM)是中枢神经系统(central nervous system,CNS)最常见的原发肿瘤,也是神经外科临床诊疗工作中的严峻挑战。乏氧是GBM微环境的重要特征,能够驱动GBM恶性进展;但是乏氧介导的肿瘤相关巨噬细胞(Tumor associated macrophages,TAMs)与GBM细胞的交互在GBM进展中的作用和机制尚需进一步研究。
南京医科大学附属脑科医院刘宏毅教授课题组在Theranostics杂志发表题为“Hypoxia-driven M2-polarized macrophages facilitate the epithelial-mesenchymal transition of glioblastoma via extracellular vesicles”的论文,报道了乏氧的GBM微环境能够促进TAMs向M2型极化,M2型TAMs通过微囊泡调控GBM的上皮-间质转化进而促进GBM进展,并且在揭示分子机制的基础上,以脂质体为载体开发了安全且有效的纳米药物。第一作者:刘亮博士、王冉博士以及唐祥龙副研究员,通讯作者:南京医科大学附属脑科医院刘宏毅教授、杨坤副教授以及肖红教授。
在此项研究中,研究人员发现GBM组织中浸润了大量巨噬细胞,约占实体瘤组织的29.27%;乏氧的GBM微环境可“驯化”巨噬细胞向M2型TAMs极化;极化后的M2型TAMs能够分泌富含circ_0003137的细胞外微囊泡;这些微囊泡被GBM细胞吞噬后,导致GBM细胞中circ_0003137的表达上调;上调后的circ_0003137通过靶向PTBP1/PLOD3轴促进GBM的EMT进程从而驱动GBM进展。此外,研究人员基于脂质体开发了负载sh-circ-0003137的纳米药物,体内、外实验证实该纳米药物能有效抑制GBM进展、显著改善荷瘤鼠的生存。
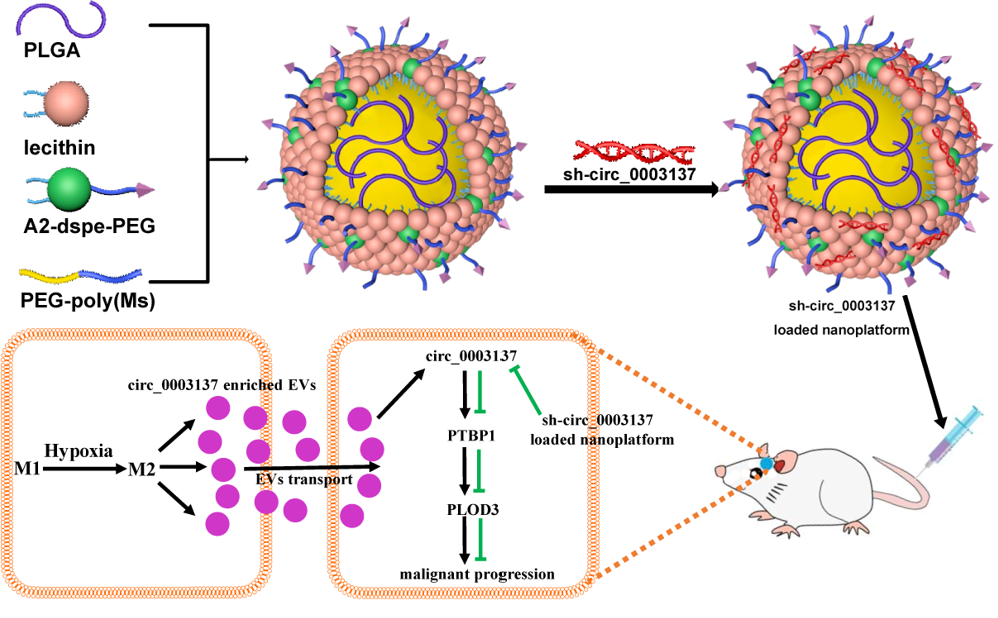
参考文献:Hypoxia-driven M2-polarized macrophages facilitate the epithelial-mesenchymal transition of glioblastoma via extracellular vesicles. Theranostics 2024; 14(16):6392-6408. doi:10.7150/thno.95766.
外泌体资讯网 Theranostics|南京医科大学附属脑科医院刘宏毅团队:乏氧驱动的M2型TAMs通过微囊泡促进胶质母细胞瘤上皮-间质转化





