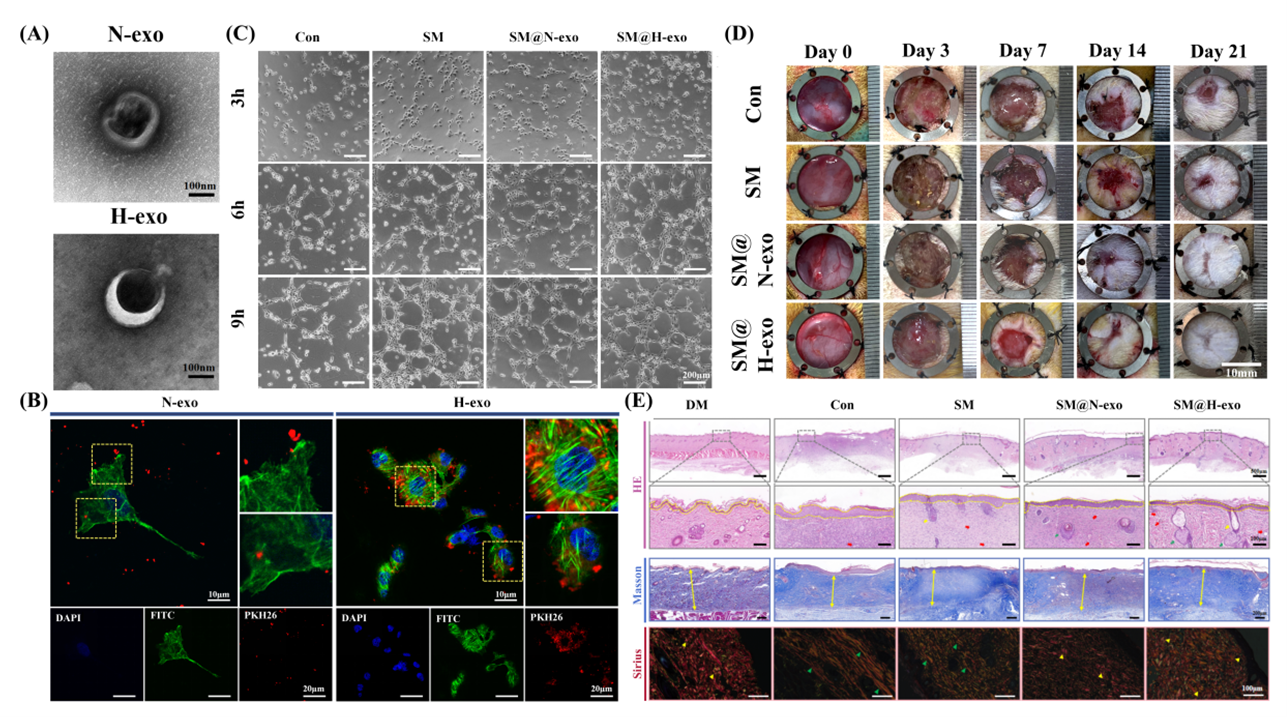
中国每年有超过300万例糖尿病足溃疡新病例,导致超过28万例下肢截肢。糖尿病患者常见的微血管病变和大血管疾病导致血流量减少,降低了氧气和营养物质的供应,从而导致难愈慢性创面的产生。近年来,以间充质干细胞(mesenchymal stem cells,MSCs)为基础的治疗在糖尿病创面修复方面显示出了巨大的应用前景。其中旁分泌作用参与了MSCs治疗多种疾病的潜在作用机制,而外泌体在这一过程中发挥重要作用。但外泌体的低保留率和体内不稳定性阻碍了其治疗效果,细胞外基质水凝胶因其的成分和结构类似于自然的胞外基质,且具有良好的生物相容性和组织活性,可以作为一种理想的载体,用于外泌体的负载和释放。近日,四川大学华西医院生物治疗全国重点实验室解慧琪研究员团队在Biomaterials杂志上发表题为“Exosomes from Hypoxic Urine-derived Stem Cells Facilitate Healing of Diabetic Wound by Targeting SERPINE1 through miR-486-5p”的论文(2024 Oct 15:314:122893)。该研究探究了来自低氧诱导的尿源性干细胞外泌体对血管生成的影响。低氧条件改变了外泌体内miRNAs的种类,其中miR-486-5p的上调抑制了内皮细胞中SERPINE1的活性,从而促进血管生成,血管生成的机制可能与经典的HIF-1α信号通路的激活有关。此外,作者还开发了一种易于制备和具有良好生物相容性的细胞外基质水凝胶材料SISMA,用于负载和缓释外泌体,对糖尿病创面的愈合产生协同作用。论文第一作者为四川大学华西医院的硕士研究生范明慧和博士后张秀珍,四川大学华西医院的解慧琪研究员为该文章的通讯作者。
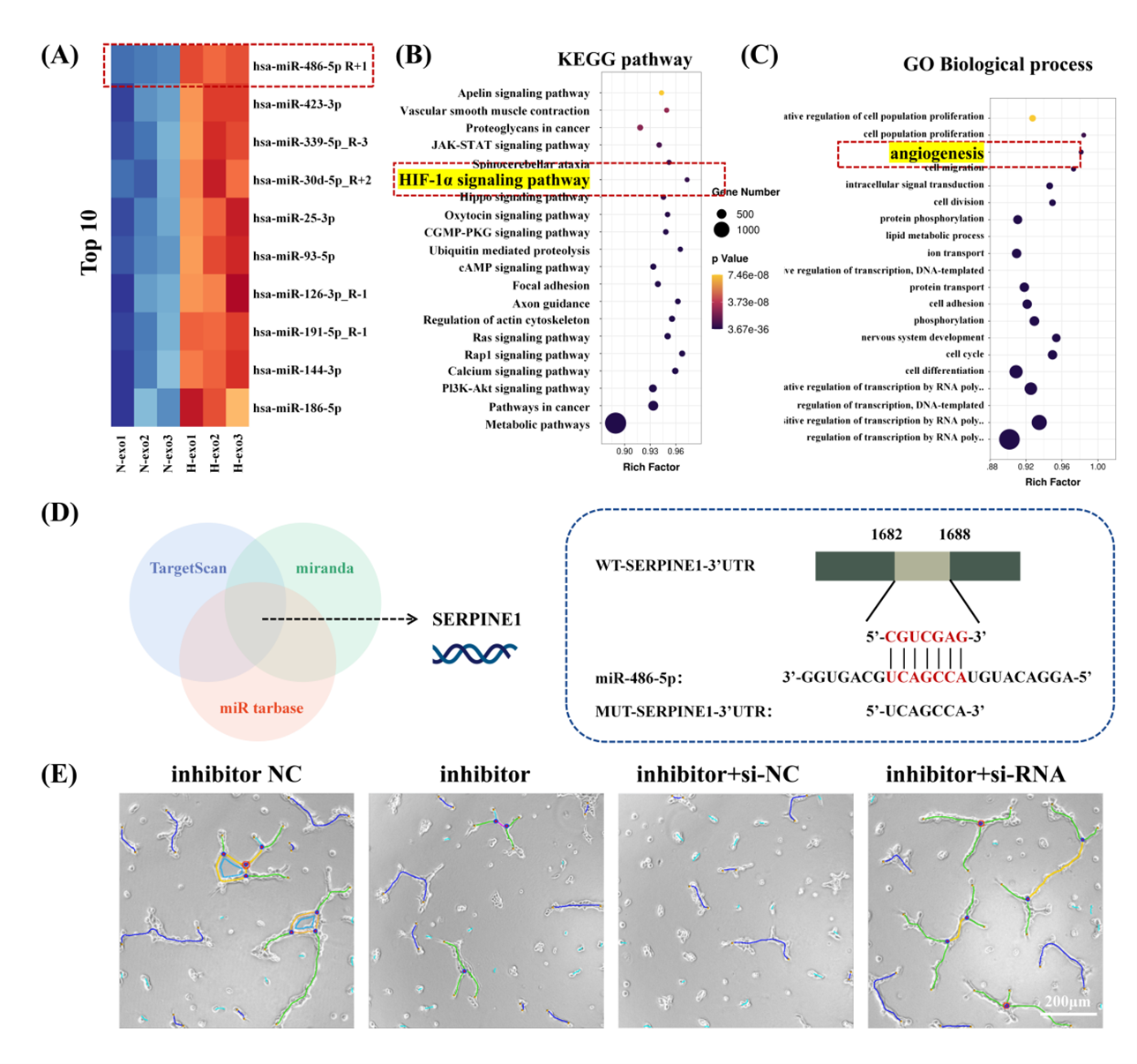
负载低氧诱导USCs外泌体的SISMA水凝胶体外促进了内皮细胞的增殖、迁移和成管。在糖尿病全层皮肤缺损模型中,该复合材料可以通过促进血管化,再上皮化和胶原沉积,显著加速创面愈合。为了探讨低氧刺激如何介导外泌体促进组织修复的潜在机制,作者利用miRNA测序技术对外泌体进行了分析。结果显示,低氧条件改变了外泌体内miRNA的功能谱,特别是miR-486-5p的上调,这抑制了内皮细胞中SERPINE1的活性,血管生成增强的机制可能与经典的HIF-1α信号通路的激活有关。体外验证实验也证明,SERPINE1的沉默可以消除miR-486-5p抑制剂对HUVECs迁移和成管产生的不利影响。Exosomes from hypoxic urine-derived stem cells facilitate healing of diabetic wound by targeting SERPINE1through miR-486-5p. Biomaterials 2025;314:122893. Doi: 10.1016/j.biomaterials.2024.122893.外泌体资讯网 Biomaterials|四川大学华西医院生物治疗全国重点实验室解慧琪研究员团队:低氧诱导尿源性干细胞外泌体促糖尿病创面愈合