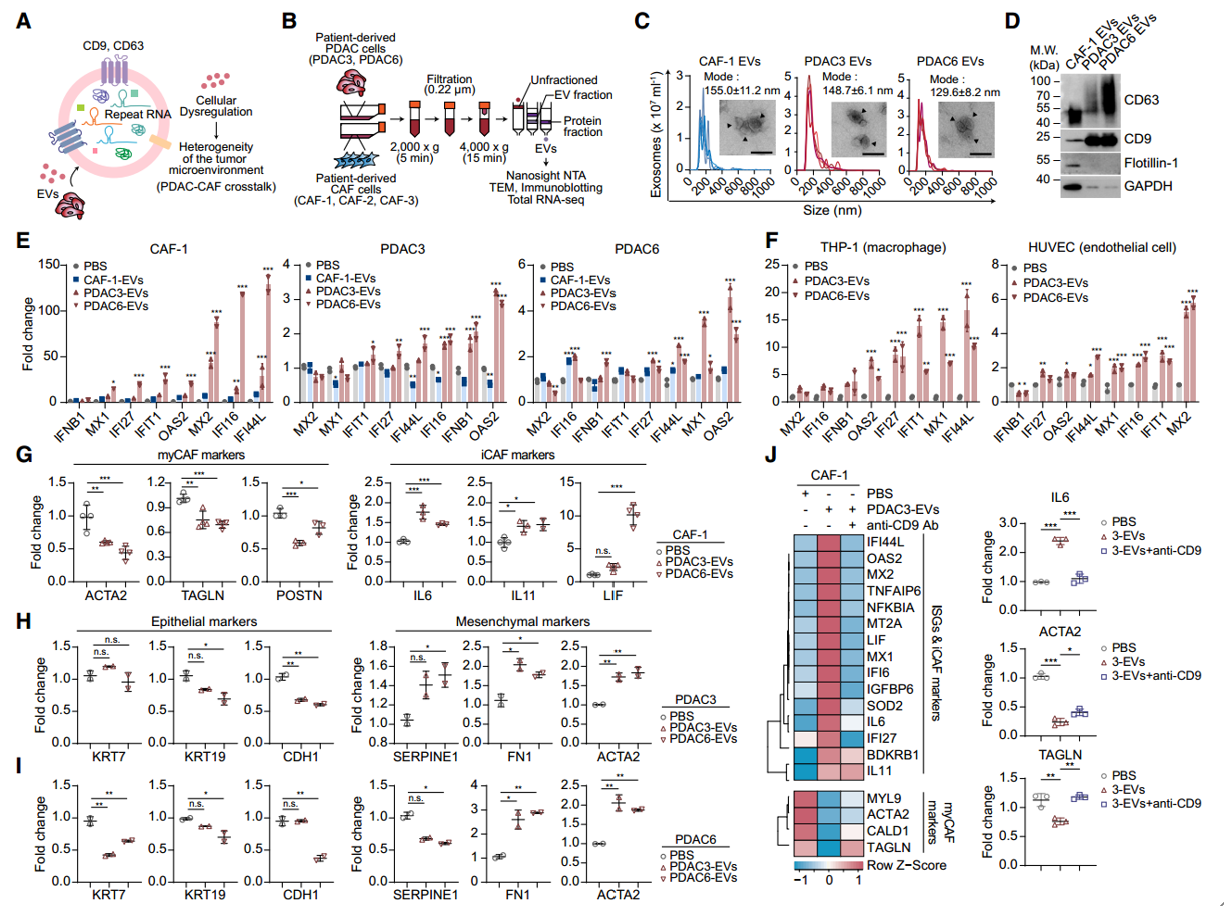
胰腺导管腺癌(PDAC)是成年人中最致命的恶性肿瘤之一,其高度侵袭性行为是由肿瘤内在和外在因素的结合引起的。最近的研究揭示了PDAC细胞和癌症相关成纤维细胞(CAFs)的显著单细胞异质性,这些细胞构成了肿瘤微环境(TME)的主要部分。胰腺导管腺癌(PDAC)中异常表达的重复RNAs模拟了病毒样反应,对肿瘤细胞状态和周围微环境的反应产生影响。之前的研究表明,不同的重复RNA子类表达模式与不同的肿瘤细胞内在状态和免疫微环境相关。具体来说,人类着丝粒卫星II(HSATII)重复序列被观察到与多种癌症中的免疫抑制性TME相关,并在去分化的间充质或神经内分泌肿瘤细胞状态中富集,这些状态与转移功能倾向和化疗耐药相关。然而,我们对PDAC细胞和TME中重复RNAs的空间关系以及这些病毒样物种的功能性细胞间通信的理解仍然有限。
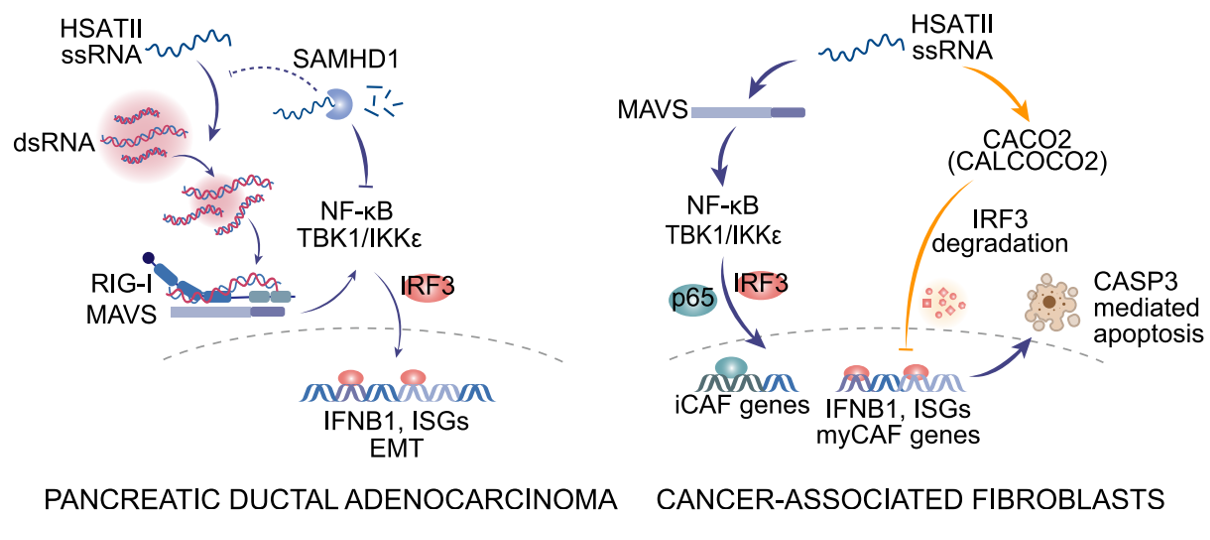
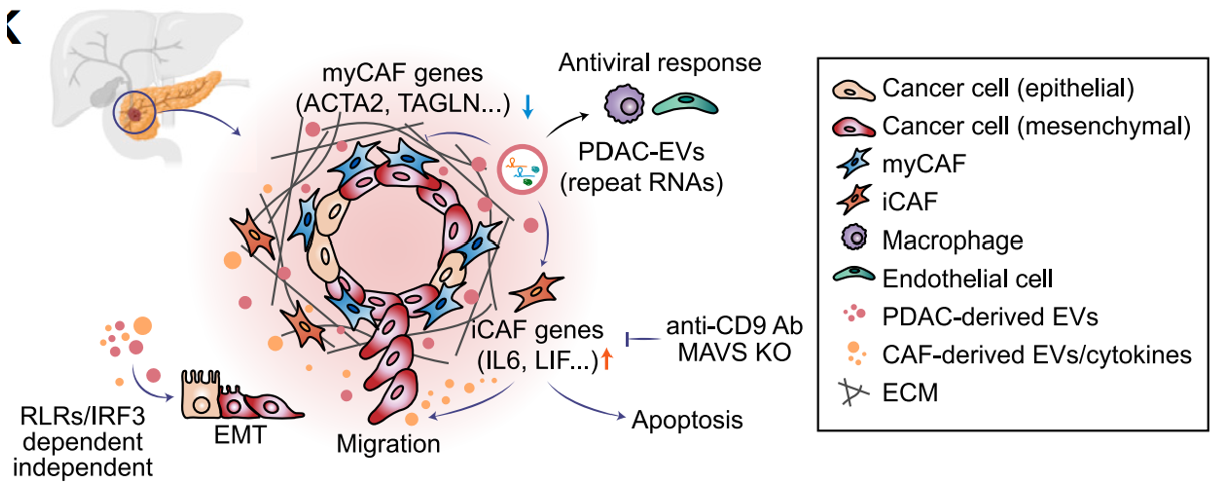
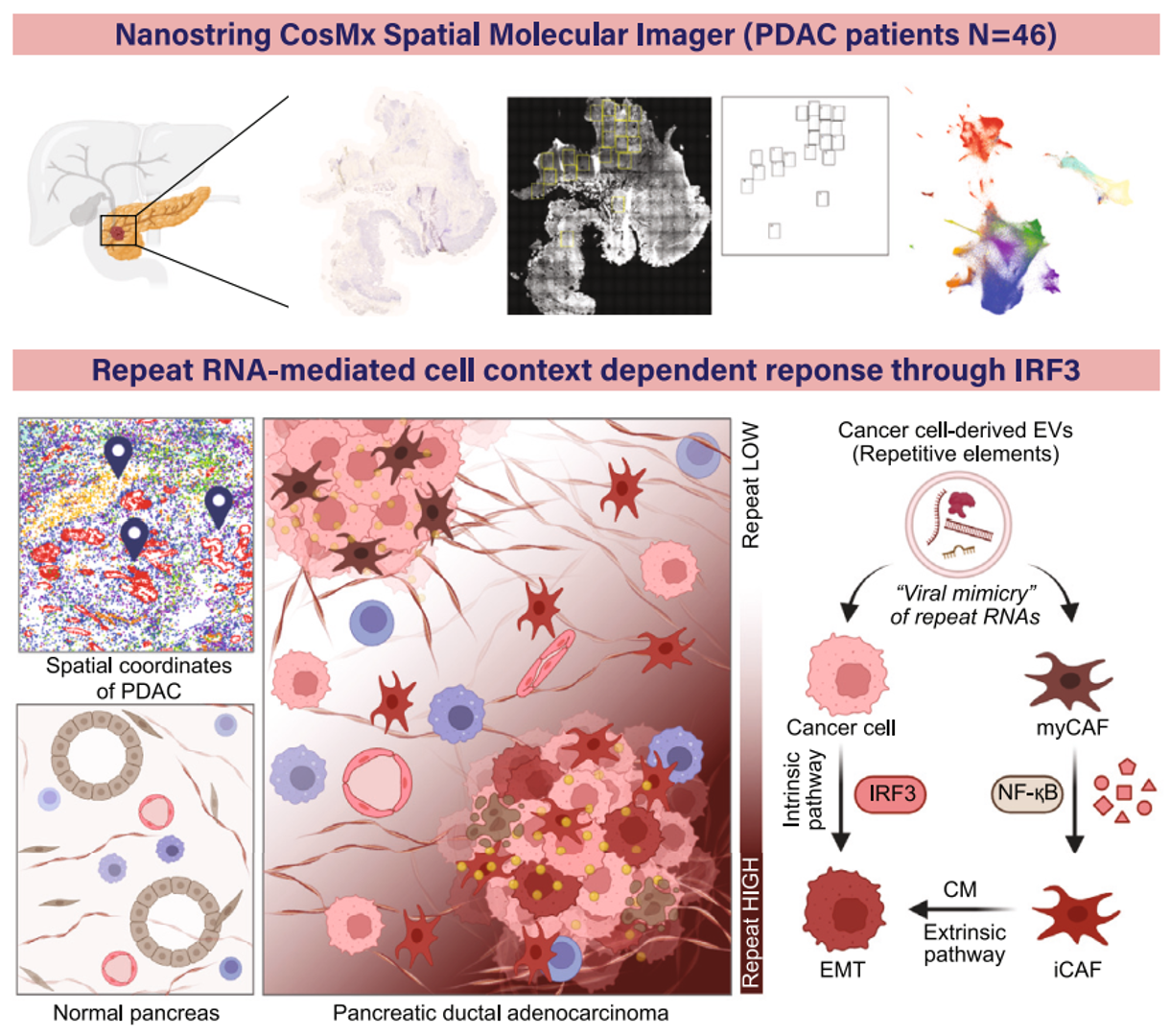
为了更好地理解人类PDAC中重复RNAs的关系,近期Cell杂志上的一篇报道在46个原发性肿瘤中进行了单细胞分辨率的空间分子成像,揭示了高重复RNA表达与PDAC细胞上皮状态改变和癌症相关成纤维细胞(CAFs)中肌成纤维细胞表型变化的相关性。在PDAC和CAF细胞培养模型中,通过外泌体(EVs)和单个重复RNA的给药观察到的这种细胞身份丧失,指出了这些病毒样元素的细胞间通信。PDAC和CAF反应的差异由通过干扰素调节因子3(IRF3)的不同先天免疫信号驱动。细胞环境特异性的重复RNAs病毒样反应为调节PDAC微环境中不同细胞类型的细胞可塑性提供了机制。细胞外囊泡(EVs)可以感染肿瘤微环境(TME)和邻近的PDAC细胞,诱导细胞身份的丧失该研究首次展示了PDAC原发性肿瘤中这些重复元素的空间分布,揭示了重复RNA表达与癌细胞及其周围微环境中细胞状态改变的相关性。该研究展示了重复RNAs驱动的细胞变化在患者来源的PDAC和CAF细胞系中的功能性证据,并识别出这些细胞类型之间对重复RNA的不同干扰素(IFN)响应信号,导致不同的细胞状态。含有丰富重复RNAs的细胞外囊泡(EVs)被证明为PDAC和CAF细胞之间的细胞间通信提供了一种病毒样的传递载体。HSATII RNA在PDAC和CAF中诱导的抗病毒反应尽管之前的研究已经表明,通过对这些元素的广泛去抑制(使用遗传抑制或表观遗传调节剂的小分子抑制剂),重复RNAs可以激活先天免疫反应,但对个别重复类型的反应差异以及细胞类型的情境依赖性尚未得到充分表征。每种重复子类型(LINE-1、HERV-K、HSATII)都能够在PDAC和CAF细胞中诱导IFN反应,并在各自的细胞类型中伴随着EMT基因的增加和myCAF基因的减少。然而,这些RNAs之间的转录和功能反应的效力是不同的,这说明了不同重复RNAs在先天免疫信号响应中的特异性的重要性。之前的研究显示了HSATII RNA作为甲基-CpG结合蛋白2(MeCP2)的分子海绵的影响,对染色质结构和染色体不稳定性有深远影响。同样,LINE-1 RNA物种也被发现影响染色质的分布和凝聚。研究结果基于这些发现,揭示了通过一种此前未被描述的IRF3依赖性分子反应,重复RNAs在PDAC和CAF细胞中介导的细胞失调现象。HSATII RNA与EVs在PDAC肿瘤微环境(TME)中的相互作用示意图这是首次使用空间分子成像(SMI)来解析人类PDAC肿瘤中重复RNAs的精确定位。研究展示了重复元素的独特空间分布梯度,这与这些病毒样元素向周围肿瘤微环境(TME)的运输一致。PDAC和CAF细胞中的重复RNA水平与上皮和肌成纤维细胞基因表达的丧失相关,支持重复RNA诱导的分化丧失。在PDAC和CAF细胞系模型中展示了对重复RNA表达的功能性和转录反应,表现出与空间转录组学分析一致的IFN反应基因表达和细胞身份丧失。这种对这些重复RNA的深刻先天免疫反应与其他模型中报道的病毒模拟反应一致。最近的研究还表明,在小鼠模型中,PDAC肿瘤细胞中的重复元素低甲基化可以驱动重复RNA表达,诱导IFN反应和促炎性的肿瘤促进性微环境。此外,这种炎性反应驱动myCAF向iCAF的极化,支持了促肿瘤的微环境,越来越多的证据表明myCAF的耗竭可以促进肿瘤进展。- 单分子成像提供了人类PDAC中重复RNA和编码RNA的空间图谱
- 对重复RNA的干扰素反应扰乱了PDAC肿瘤中的多种细胞类型
- CAFs和PDAC细胞对重复RNA的不同反应由IRF3驱动
先前的研究表明,PDAC与CAF细胞间的相互作用在传统的受体-配体关系中具有重要性,包括TGF-β、IL-6、IL-1、CXCL12和SHH。最近的研究显示,肿瘤来源的细胞外囊泡(EVs)作为多种不同分子(包括RNA、蛋白质和脂质)的传递载体,可以调节局部和远处微环境以促进肿瘤进展。EVs的RNA内容被证明包括多种不同的RNA种类,包括miRNA、环状RNA和重复RNA。这些富集在肿瘤来源EVs中的非编码RNA被报道可以调节基因表达,影响免疫耐受性和化学耐药性。此外,基质CAF EV与肿瘤和免疫细胞的相互作用已被证明与非编码RNA RN7SL1有关。考虑到这一点,通过EV传递的重复RNA介导的myCAF表型逆转和PDAC细胞EMT的诱导,提供了一种重复RNA诱导的先天免疫激活机制,从而在不同细胞类型中改变细胞可塑性,趋向于更具侵袭性的肿瘤行为。该研究重要的发现是PDAC和CAF细胞对EVs和重复RNA的不同反应。IRF3驱动了在myCAF和PDAC EMT中共有的间充质基因的表达。在PDAC和CAF细胞中,这种IRF3-间充质程序在对重复RNA的响应中呈现相反的方向。在重复RNA转染后,IRF3蛋白在CAF中减少,导致myCAF基因表达下调,而在PDAC细胞系中,IRF3保持完整且持续激活,诱导间充质基因表达。因此,由PDAC来源的EVs在肿瘤-基质界面富集并传递的相同重复RNA可以导致myCAF细胞身份的丧失和间充质PDAC表型的获得。总之,该研究的数据表明,由肿瘤细胞驱动的内源性病毒样反应对癌细胞的单细胞异质性和胰腺癌微环境具有广泛影响,揭示了癌症病毒基础的新维度。You E, Danaher P, Lu C, Sun S, Zou L, Phillips IE, Rojas AS, Ho NI, Song Y, Raabe MJ, Xu KH, Richieri PM, Li H, Aston N, Porter RL, Patel BK, Nieman LT, Schurman N, Hudson BM, North K, Church SE, Deshpande V, Liss AS, Kim TK, Cui Y, Kim Y, Greenbaum BD, Aryee MJ, Ting DT. Disruption of cellular plasticity by repeat RNAs in human pancreatic cancer. Cell. 2024 Oct 1:S0092-8674(24)01072-9.外泌体资讯网 【Cell】细胞外囊泡参与胰腺癌中重复RNAs对细胞可塑性的破坏