小型细胞外囊泡(sEVs)在各种生物背景中是重要的细胞间信息传递者,但它们的释放过程仍然不甚了解。来自日本东京大学的研究人员描述了一种高通量检测平台,即CRISPR辅助的单条形码标记的sEV释放调节因子筛选(CIBER)平台,用于识别sEV释放中的关键参与者。条形码定量使得能够以大规模平行的方式估算每个细胞释放的sEV数量。在CRISPR池筛选格式中,使用不同的sEV标记物对sEV进行条形码标记,可以以亚群体特异性的方式进行全基因组探索sEV释放调节因子,成功识别出先前未知的sEV释放调节因子,并揭示了CD63+/CD9+ sEV的外泌体/外囊泡特性,以及CD9+ sEV释放与细胞周期的同步性。CIBER将成为研究sEV的生物发生、释放和异质性的宝贵工具。相关内容以“Barcoding of small extracellular vesicles with CRISPR-gRNA enables comprehensive, subpopulation-specific analysis of their biogenesis and release regulators”为题在线发表于11月19日的国际知名综合性期刊Nature Communications杂志上。
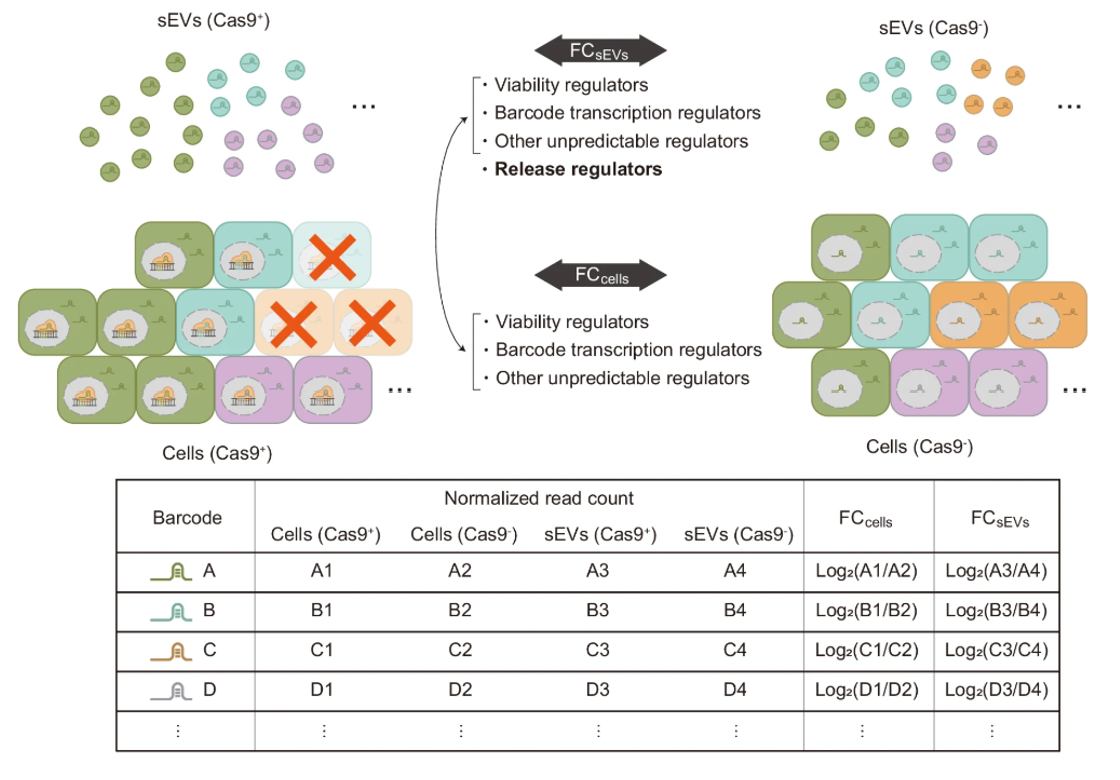
细胞释放的膜封闭型细胞外囊泡(EVs)通常根据其大小或来源被分类为几个亚型,包括小型细胞外囊泡(sEVs,直径30-200纳米)、中型/大型EVs(大于sEV的EVs)、外泌体(来源于多囊泡体(MVB))和外囊泡(来源于质膜,也称为微囊泡)。其中,含有各种生物分子的sEVs是细胞间通信的重要介质,在生理和病理背景下,包括癌症转移中发挥作用。这些事实突显了sEV生物发生和释放过程作为治疗靶点的潜力。此外,sEVs还因其高度生物相容性而受到关注,作为递送囊泡,因此控制、增强其生产的方法在生物技术应用中备受关注。尽管sEV释放过程的重要性,关于其调节的全面理解仍然难以实现,原因有几个。首先,多个生物分子参与相互关联的通路,这使得使用传统低通量检测方法很难在单独的孔中使用小分子抑制剂或 siRNA 进行分析。其次,许多sEV释放的调节因子也会影响细胞活动,包括细胞活力,这妨碍了对控制sEV释放因子的高通量识别。第三,sEVs是异质的,不同亚群体sEV的释放机制难以区分。在这项研究中,研究人员报告了一种克服这些限制的高通量混合筛选系统及其在识别sEV释放过程关键参与者中的应用。研究人员通过gRNA与融合了sEV标记的死亡Cas9(dCas9)之间的相互作用,将Cas9的引导RNA(gRNA)主动整合到sEVs中,采用池式CRISPR筛选格式。这使得装载gRNA的sEV能够作为“条形码”,将每个sEV与其来源细胞中基因表达的调控联系起来。对sEV和细胞中条形码gRNA组成的定量分析,可以对参与sEV释放的基因进行高通量、全基因组的探索,同时消除了对细胞活动(如增殖、条形码转录)的影响。研究人员将这一检测平台称为CRISPR辅助的单独条形码标记sEV释放调节因子筛选平台(CIBER)。使用多个sEV标记结合生物信息学分析的CIBER筛选,揭示了控制sEV释放过程的已知和先前未知的因子,揭示了V型ATP酶、线粒体电子传递和细胞周期对CD63+和CD9+ sEV释放的不同影响。研究人员相信这项工作为sEV的生物发生、释放和异质性研究提供了基础。研究人员也讨论了这一sEV条形码平台在未来各种应用中的潜力。
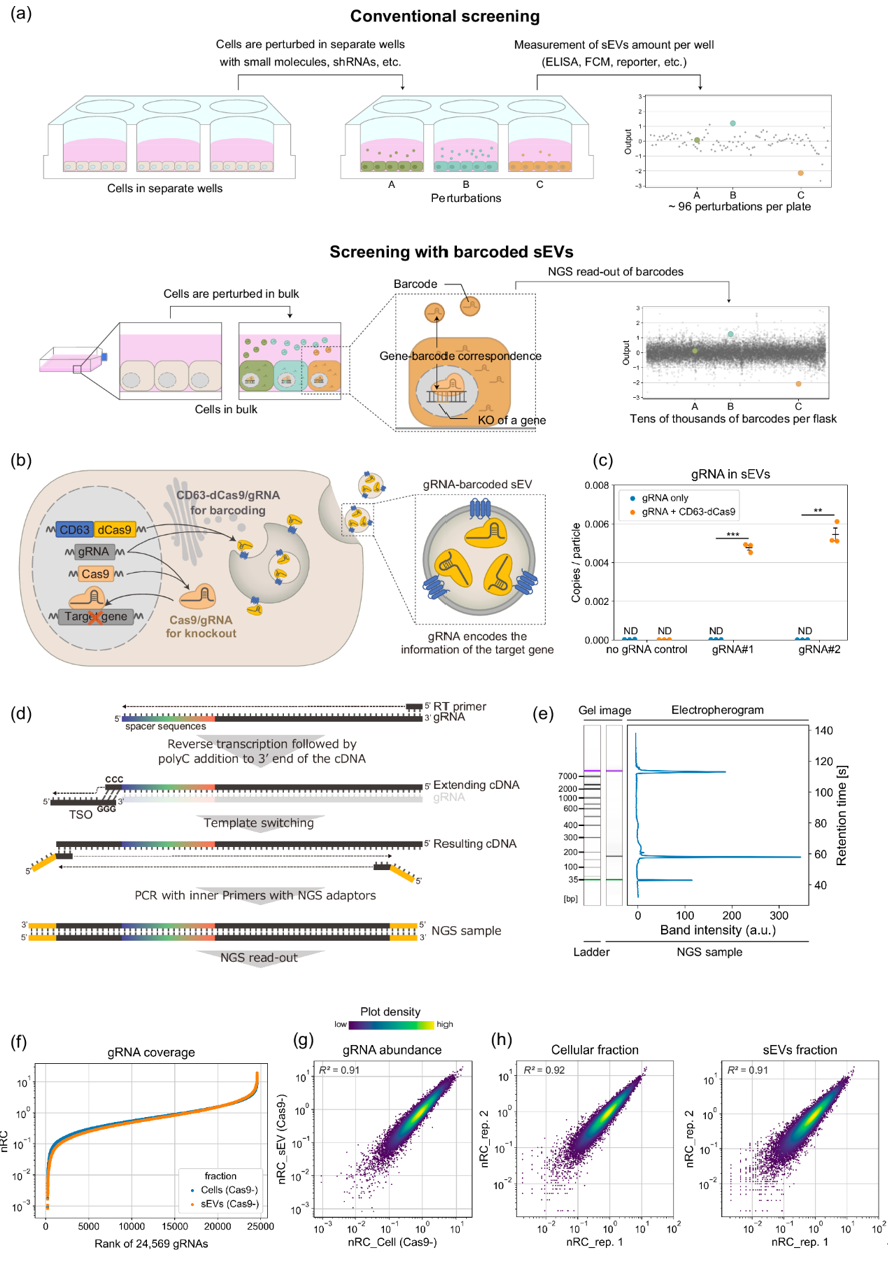
图:用于高通量分析sEV释放调节因子的gRNA条形码化sEV的概念和创建。a “条形码”sEV的使用示意图。传统的生物检测(例如,通过在不同孔中处理细胞并测量每个孔中释放的sEV数量)仅提供相对较低的通量。另一方面,条形码化的sEV与CRISPR gRNA结合,允许以池式方式识别sEV释放调节因子。b 条形码化gRNA的sEV生成示意图。通过在sEV产生细胞中共同表达CD63(sEV标记)和死亡Cas9(dCas9)的融合蛋白以及Cas9,可以主动将用于基因敲除的gRNA封装在sEV中。c 从HEK293T或稳定转导gRNA的CD63-dCas9表达的HEK293T细胞的培养基中分离的sEV中gRNA的丰度。通过qPCR确定gRNA的拷贝数,并按颗粒数进行划分。没有CD63-dCas9的gRNA#1和#2的qPCR Ct值与无gRNA对照没有显著差异。d 为下一代测序(NGS)开发的间隔扩增方法的示意图。e 从sEV RNA制备的NGS样本的Bioanalyzer电泳图。f gRNA的覆盖率。表达CD63-dCas9的细胞使用慢病毒转导了24,569个gRNA的文库(DTKP文库)。从细胞和从中释放的sEV中提取的RNA被处理以进行NGS读取。每个单一gRNA的读取计数除以总样本计数,然后乘以文库中的gRNA数量(24,569),以计算归一化读取计数(nRC),使得平均值为1。g 来自Cas9−细胞的两个重复培养中sEV和细胞组分中24,569个gRNA的nRC之间的相关性。h 通过NGS测量的来自细胞和sEV组分的24,569个gRNA的nRC的可重复性。参考文献:Barcoding of small extracellular vesicles with CRISPR-gRNA enables comprehensive, subpopulation-specific analysis of their biogenesis and release regulators. Nat Commun. 2024 Nov 19;15(1):9777.




