细胞外囊泡(EVs)是多样化的纳米颗粒,在大小和分子组成上表现出高度异质性。尽管这种异质性为液体活检提供了很高的诊断价值,并赋予其在癌症检测、伤口愈合以及神经退行性疾病和心血管疾病的治疗应用中许多可利用的功能,但它也阻碍了EV的临床转化——因此,异质性如同一把双刃剑。来自加利福尼亚大学戴维斯分校的研究人员在Nature Nanotechnology杂志上发表综述文章,回顾了亚群异质性对EV功能的影响,提出了针对异质性挑战的可能解决方案。
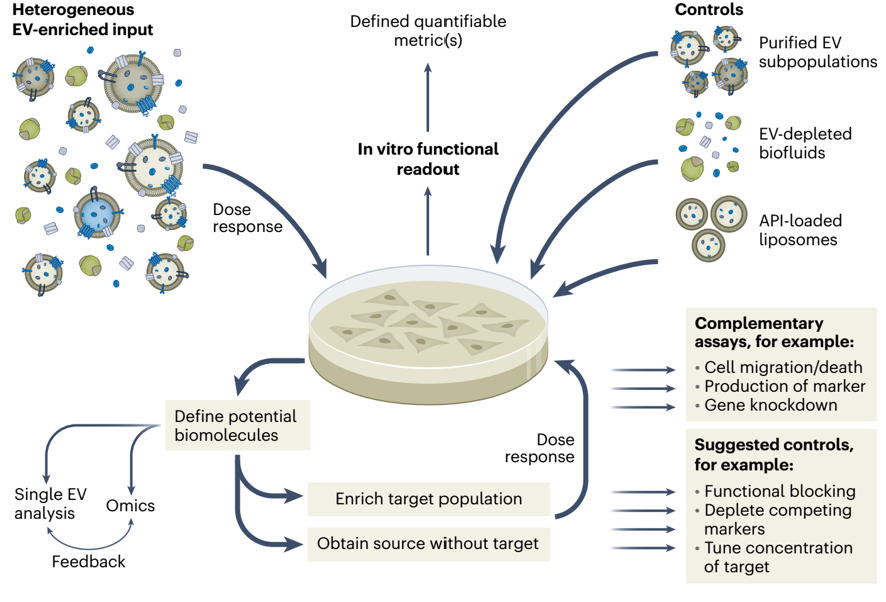
细胞外囊泡(EVs)是一种复杂的生物材料,由丰富的脂质、甾醇、膜蛋白和糖类构成的膜包围着一个含有蛋白质、核酸、代谢物、细胞因子及其他可影响生物功能的可溶性介质的水性腔体。EVs展现出许多固有特性,使其在纳米药物递送方面极具吸引力。其中一些在循环体液中表现出增强的滞留能力,并且可以具有免疫耐受性,从而避免被吞噬清除并延长循环中的半衰期。另一些似乎具有器官趋向性,可以靶向远处组织中的特定细胞(尽管目前仅鉴定出少数精确机制),从而影响细胞通信、迁移、分化和增殖。EVs介导细胞的应激反应,并通过主动进入和融合被大多数细胞迅速吸收。它们的纳米级尺寸使其通过肿瘤的渗漏血管以增强的通透性和滞留(EPR)效应被动地被组织吸收(尽管针对EPR效应到达深部肿瘤的程度和实用性仍存在争议)。有报告指出,EVs可以穿越内皮屏障,包括血脑屏障(BBB),尽管具体机制仍大多未知。它们能够引发强大的功能反应,包括抑制抗肿瘤免疫、改变肿瘤微环境以及诱导血管生成。它们还具有可塑性,适合进行基因操作或外源性负载,能够利用其固有特性并设计新的功能。尽管具有这种潜力,将EVs有效用于临床治疗的方法尚未实现——目前美国食品和药物管理局尚未批准任何EV制剂,尽管已有多项研究证实了其良好的安全性特征。通向临床转化的道路上存在许多障碍,包括质量控制的一致性差距以及与监管指南的不匹配。该综述关注这些障碍上游的一个关键问题——EVs的内在异质性,这指的是单个EV中分子分布的差异性。图1、EV表现出显著的异质性,这目前限制了其在药物递送中的有效应用。解决EV异质性的第一个基石是使用多种互补的单颗粒表征技术对其进行评估。
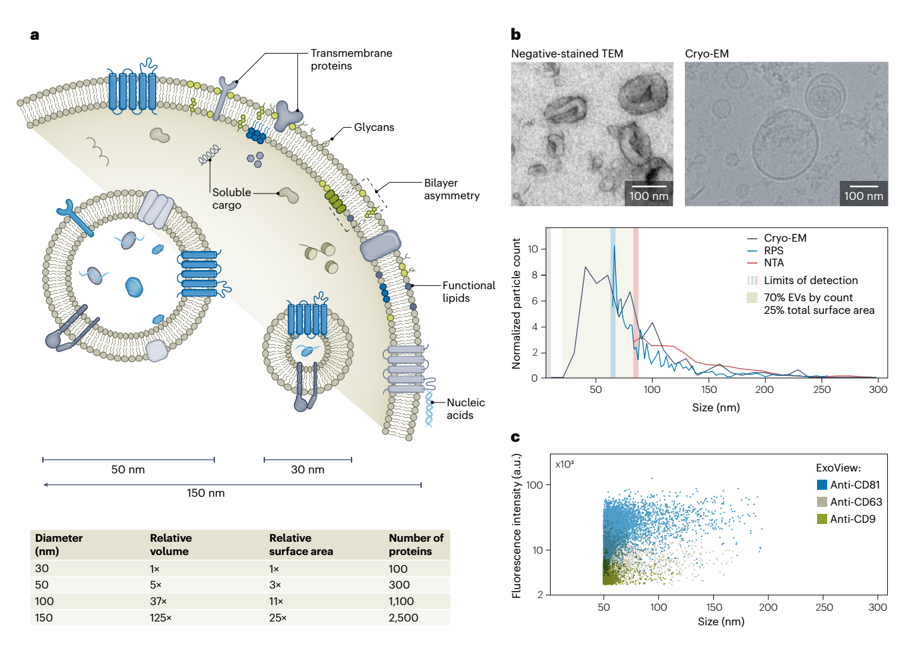
a,EV在大小上表现出异质性,从约30 nm到超过150 nm。由于体积、表面积和组成(例如膜成分和可溶性货物)的巨大差异,最小和最大的EV不太可能表现出相似的功能。对于特定的囊泡大小,其相对体积、表面积和膜蛋白数量成比例变化。
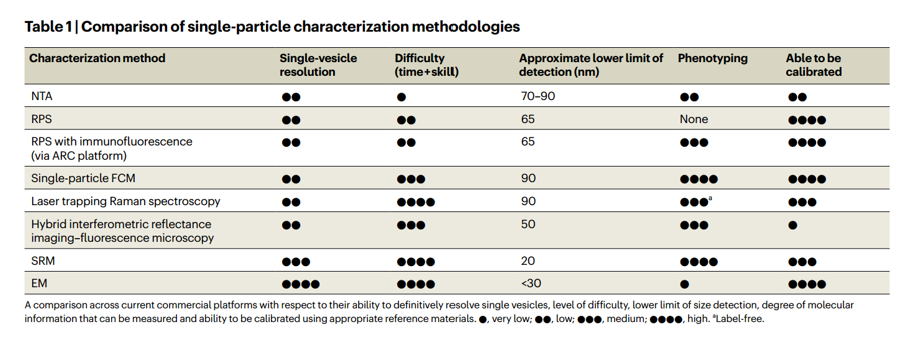
b,单颗粒大小测定(通过负染TEM、冷冻电镜(cryo-EM)、电阻脉冲传感(RPS)和纳米颗粒跟踪分析(NTA))显示出高度的多分散性,其中按数量计算多达70%的EV(按表面积计算为25%的EV)小于80 nm,这低于NTA的尺寸检测阈值。
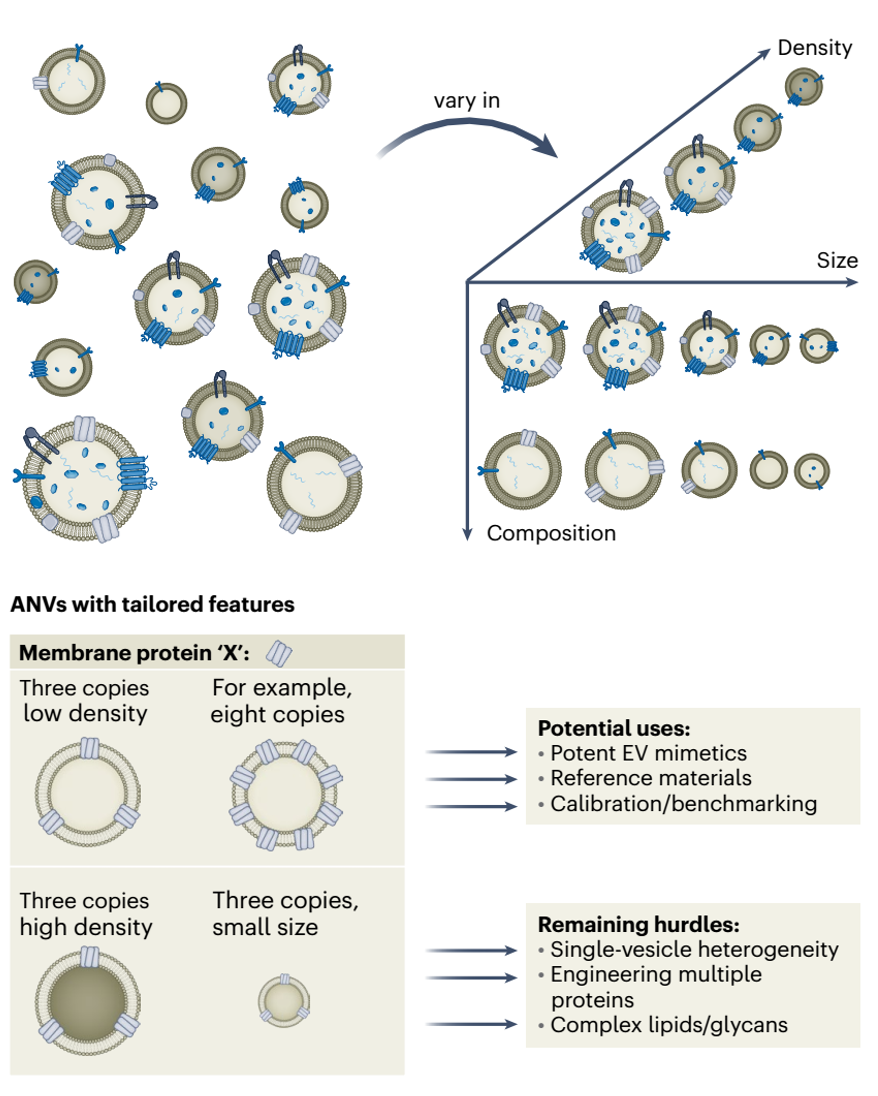
c,使用单颗粒免疫荧光测量的分子信息表明,常见的膜蛋白(即四跨膜蛋白CD9、CD63和CD81)随着直径的变化而不同。EV的异质性意味着单个囊泡并不具备所有归属于整体囊泡群的化学或物理特性,这暗示着每个囊泡也可能不具备归属于整体的功能特性。鉴于单个囊泡执行特定功能的能力取决于其精确的组成,只有具有特定化学组成的EV群体才可能负责实现某种特定功能。即使是来自单一细胞的EV,其组成也存在异质性,因此无论来源的均一性如何,功能性亚群都可能存在。为了更好地描述这一现象,该综述使用“亚群异质性”一词,包括“亚群间异质性”(指来自不同来源EVs的组成和功能差异)和“亚群内异质性”(指来源于同一来源的EV亚群内部的差异),在相关情况下具体标明“亚群间”或“亚群内”。例如,EVs潜在效用的一个核心主张是,与游离药物或脂质体相比,EVs具有较长的循环半衰期。然而,一些研究报告EV的半衰期不足10分钟,而表达CD47的EV亚群的半衰期则显著更长。因此,分子组成(如CD47)以及其他特性(如EV的大小)上的异质性导致了空间分布的多样性,并进一步影响生物学反应。图2、在单囊泡异质性背景下确定EV作用机制(MOA)的通用实验流程。解决EV异质性的第二个基石是开发体外功能研究以明确作用机制(MOA)。EV富集的产物应在具有明确可量化指标的互补功能实验中进行剂量测试。示意图左侧和中间的粗箭头展示了定义潜在生物分子的理想化路径(理想情况下定义其在单颗粒中的分布),通过这些生物分子富集目标亚群,并针对不含目标的EV来源重复实验。根据实验的具体背景,示意图右侧总结了各种对照。输入对照(如纯化的EV亚群、去除EV的生物液体或负载目标生物分子或活性药物成分(API)的脂质体)应尽可能使用。为了帮助明确MOA,应对目标生物分子进行功能阻断或其他操作。当考虑EV分离或富集平台对EV异质性的额外影响时,这些问题更加复杂。在文献中可以找到许多关于EV功能的高度不同的报告实例,这进一步突出了EV的固有异质性。因此,作者认为,EV的内在异质性是目前阻碍其向转化治疗应用发展的关键障碍。该文重点介绍了EV亚群异质性的已知特性及其对治疗功能表现的影响。作者回顾了现有能够以单囊泡分辨率表征EV异质性的技术,包括其优点和缺点。最后,概述了解决EV异质性障碍的三个基石:(1)需要谨慎实施互补方法论以充分表征EV;(2)需要建立标准化的功能测定方法,以在特定应用背景下比较EV亚群;(3)需要利用具有明确特性的仿生EV这一不断发展的研究领域。综合来看,这些步骤将有助于识别和利用明确的作用机制(MOAs),并极大地加速EV治疗的开发,无论是来源于内源性EV还是工程化制剂。图3、通过工程化人工合成纳米囊泡(ANVs)解决与EV相关的长期挑战。解决EV固有异质性的第三个基石是使用合成ANVs。本质上,天然EVs存在于高度复杂混杂的群体中,其大小、密度和分子组成等方面各不相同,而ANVs理论上可以通过高度可控的分子内容(例如,特定的目标蛋白“X”)、大小和密度进行定制。尽管此类材料可以作为EV疗法的基准或替代/补充,但仍然存在评估ANV异质性的挑战,并且在合成与天然EV复杂性匹配的囊泡(例如,每个囊泡包含多种膜蛋白、复杂的脂质和/或糖类修饰)的技术能力方面仍然滞后。Carney RP, Mizenko RR, Bozkurt BT, Lowe N, Henson T, Arizzi A, Wang A, Tan C, George SC. Harnessing extracellular vesicle heterogeneity for diagnostic and therapeutic applications. Nat Nanotechnol. 2024 Oct 28. doi: 10.1038/s41565-024-01774-3. PMID: 39468355.外泌体资讯网 【Nat Nanotechnol】利用细胞外囊泡的异质性用于诊断和治疗应用