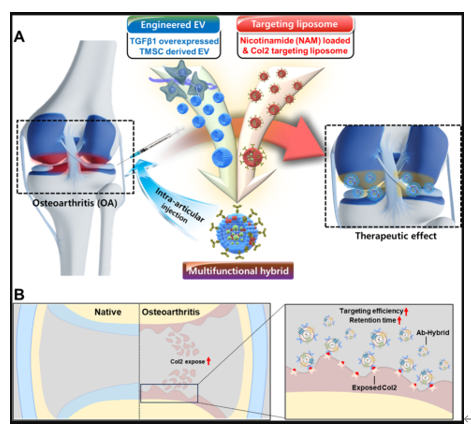
细胞外囊泡(EVs)具有其母细胞的特征,因此各种研究积极探讨利用间充质干细胞衍生的EVs进行疾病治疗,因为它们具有再生活性。此外,近年来,工程化EVs以改善其原生活性并整合额外功能而备受关注。虽然内源性和外源性方法都用于工程化EVs,但内源性方法可能面临向经历代谢变化的细胞施用物质的问题,这可能导致潜在的副作用。此外,外源性方法在工程过程中可能由于膜破坏而失去EVs内部的有益因子。EVs的表面修饰也可能由于EV表面存在蛋白质而降低效率。这些都导致工程化EV存在着诸多不利。来自韩国抱川中文医科(CHA)大学的研究人员通过乙醇介导的EVs与功能化脂质纳米颗粒(LNPs)与融合脂质成分的杂交,达成了一种稳定且高效的工程化方法。在杂交过程中,内部生物活性因子和靶向部分得以保留,使其具有LNPs和EVs的特征。通过与包裹烟酰胺和修饰Col2A1抗体的脂质体以及TGF-β1过表达的EVs进行杂交成功合成的Ab-Hybrid,用于治疗经内侧半月板手术不稳定的骨关节炎(OA)诱导大鼠。Ab-Hybrid展示了出色的软骨保护和抗炎效果,并在OA病变中具有靶向和持久的特性。这种制造混合颗粒的方法将作为一种有价值的EV工程化方法和适用于各种疾病的多功能平台技术。相关内容以“Hybrid Nanoparticle Engineered with Transforming Growth Factor -β1-Overexpressed Extracellular Vesicle and Cartilage-Targeted Anti-Inflammatory Liposome for Osteoarthritis”为题在线发表于12月8日的国际顶级纳米材料学期刊ACS Nano杂志上。
骨关节炎(Osteoarthritis,OA)是一种退行性关节疾病,影响全球众多个体,因疼痛、运动受限和关节畸形等症状导致生活质量下降。OA是一种多方面的慢性病,影响整个关节,特征为炎症、软骨下骨硬化和软骨退化。针对OA的治疗主要集中在缓解疼痛,而非完全恢复病变。各种非药物治疗方法,如患者教育、辅助技术、夹板、治疗性锻炼和物理治疗,也用于缓解疼痛并改善OA患者的功能能力。在OA患者中,常用的非手术方法是直接在病变部位注射皮质类固醇。类固醇对治疗疾病的根本原因无效,并且不适合长期治疗。此外,类固醇可能会减少软骨体积并对软骨细胞产生毒性。因此,提出了基于细胞的治疗方法,通过植入干细胞或自体软骨细胞来克服这些与皮质类固醇相关的问题。尽管这些基于细胞的治疗在少数情况下取得了成功,但它们需要移植大量细胞,导致细胞培养时间较长。此外,对于自体软骨细胞,从患者身上获取细胞的过程会导致患者显著的不适。细胞外囊泡(EVs)是由细胞分泌的纳米级颗粒,含有来自细胞的各种因子,并反映其母细胞的特征。特别是,间充质干细胞(MSCs)分泌的EVs具有再生能力,使其在对抗各种退行性相关疾病方面有效。尽管直接从MSCs分离的EVs具有明显的特性,但在其成功的临床应用上存在限制。基于内源性和外源性方法,提出了多种工程化方法,以改善EVs的原始再生特性并提供额外功能。内源性工程涉及用特定物质处理旨在产生EVs的细胞,通过控制预处理和细胞特性来获得具有改变特性的EVs。然而,即使保持这种方法处理的物质的特性,细胞的代谢过程也可能改变这些特性,从而可能影响其疗效并产生不良影响。随着利用来自各种细胞的EVs的原始生物活性物质的尝试,越来越多的研究领域探索将EVs用作药物递送系统的载体。这些尝试主要通过外源性工程方法进行,包括挤出、超声、电脉冲和冻融等技术。然而,这些外源性工程方法导致EVs内部因子的损失,使得实现EVs完整的治疗潜力变得困难。为了解决这些挑战,提出了一种基于EVs与药物包裹脂质体杂交的混合系统。该混合系统的核心策略是包装所需物质并修改脂质体的表面特性,后者相对容易进行工程化,然后通过各种方法将EVs和脂质体结合成单一颗粒。杂交过程最初通过物理刺激(如挤出、超声、电脉冲和冻融)进行支持,但这些方法并未完全克服外源性工程方法对EVs的限制,包括内部生物活性材料的损失。为了最小化在杂交过程中EVs原始生物活性材料的损失,提出了一种通过添加聚乙烯醇(PEG)来控制膜流动性的策略。PEG介导的杂交提供了一种相对非破坏性的替代方案,减少了内部因子的损失。然而,完全去除PEG是困难的,这必须解决,因为残留的PEG可能引发过敏反应的过敏性休克。此外,关节腔内滑液的快速循环,作为关节空间内的环境因素,给治疗剂在病变部位长时间停留带来了挑战。因此,开发了基于生物材料的治疗方法,以克服当前OA治疗的局限性。在这项研究中,研究人员采用乙醇介导的杂交方法来克服这些挑战,并构建一个多功能系统,结合了用于OA治疗的各种生物活性因子。简而言之,通过混合来自转化生长因子-β1(TGF-β1)过表达的扁桃体来源间充质干细胞(TMSCs)衍生的EVs(以维持软骨组织的稳态)和包裹烟酰胺(NAM)并修饰胶原蛋白II型α1(Col2A1)靶向抗体的脂质纳米颗粒(LNPs),制备了混合纳米颗粒,以促进抗炎特性和在OA病变区域的精确和长期活性。研究人员认为,每个单一颗粒的多功能特性是通过EVs与LNPs之间的完全杂交实现的。TGF-β1过表达的EVs有助于维持软骨微环境的稳态并保护软骨。此外,NAM和Col2A1抗体修饰的LNPs通过克服OA病变处滑液的快速流动展示了抗炎效果。总之,本研究提出的混合纳米颗粒可能通过多种生物活性因子的协同作用促进软骨再生。参考文献:Hybrid Nanoparticle Engineered with Transforming Growth Factor -β1-Overexpressed Extracellular Vesicle and Cartilage-Targeted Anti-Inflammatory Liposome for Osteoarthritis. ACS Nano. 2024 Dec 8. Epub ahead of print.