在目前众多的细胞外囊泡来源miRNA(EV-miRNA)定量检测方法中,逆转录-定量聚合酶链反应(RT-qPCR)仍然是常规标准方法,同时具备高灵敏度和特异性。然而,常规的RT-qPCR在检测之前通常需要EV分离、核酸纯化等大量预处理步骤,费时费力、易受干扰;并且不利于快速即时诊断的需求。与此同时,作为一类仅有约20bp左右的短链RNA,miRNA的有效扩增通常依赖于逆转录阶段添加的poly(A)尾或茎环结构,进一步提升了扩增体系与流程的复杂性。
近日,中国科学院上海微系统与信息技术研究所毛红菊研究员团队与复旦大学医学院詹成教授合作在Biosensors and Bioelectronics杂志上发表了题为“All-in-one multiple extracellular vesicle miRNA detection on a miniaturized digital microfluidic workstation”的论文(270 (2025) 116976)。该工作研发了一种基于数字微流控(Digital Microfluidics, DMF)技术的小型化EV-miRNA检测装置,可实现对血浆样本中EV-miRNA的自动化、“样本进,结果出”的全流程检测,并初步验证了其在非小细胞肺癌(NSCLC)检测中的应用价值。文章的第一作者为仝钊多、许鑫,通讯作者为周麟、詹成与毛红菊。
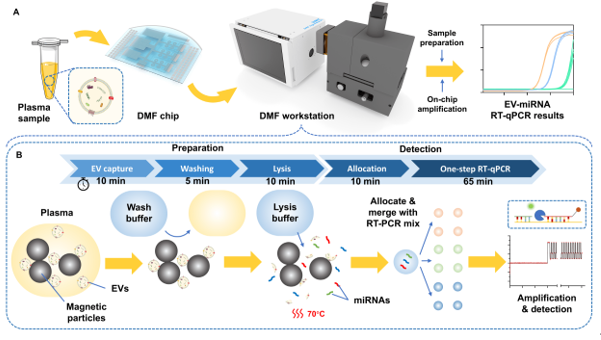
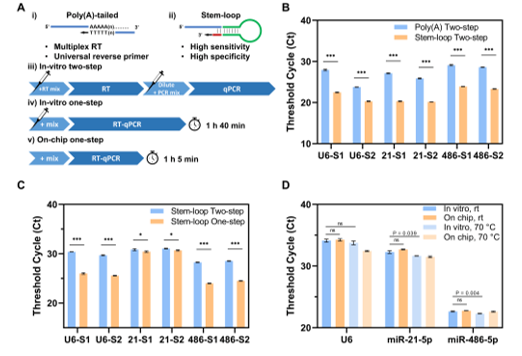
该团队基于前期工作中建立的基于DMF的快速、高效EV分离方法,进一步建立了一种小型化的DMF工作站,在自动化EV分离芯片的基础上集成了RT-qPCR检测功能。在40 × 40 mm DMF液滴操作区域内,将EV分离、EV裂解、模板分配和12个平行RT-qPCR反应进行整合。形成的检测系统可用于平行检测多种EV-miRNA标志物,并实时生成分析结果。与此同时,该团队建立了一种针对miRNA标志物的片上一步法扩增RT-qPCR体系,相比传统两步法具有更简化的反应流程与更高的灵敏度、特异性。该系统每次检测使用20 μL的初始血浆样品,可以达到与标准96孔板qPCR相当的检测能力,测得的核酸检测限为2拷贝/μL,并且总耗时控制在2小时内。此外,为了降低DMF芯片耗材的使用成本,该团队提出了一种改进的DMF芯片复用策略,使得基于MEMS工艺制备的高精度DMF芯片可以较低的成本获得与使用。最终,在该系统上使用临床样本对NSCLC相关的EV-miRNA标志物进行了验证测试,结果表明对于14例参与患者样本与17例对照样本,相关EV-miRNA表达量存在显著性差异(AUC = 0.9034),证明了该系统在疾病标志物检测中的适用性以及EV-miRNA在肿瘤诊断领域的潜在应用价值。
图1 DMF小型工作站的外观与工作流程
图2 miRNA一步法RT-qPCR扩增体系与传统方法对比
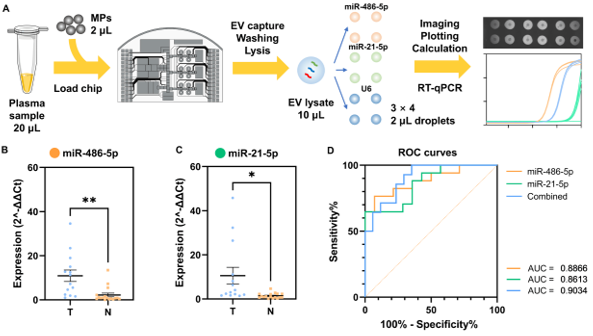
图3 NSCLC临床样本测试流程与结果参考文献:Tong Z D, Xu X, Shen C J, Yang D W, Li Y, Li Q S, Yang W D, Xu F L, Wu Z H, Zhou L, Zhan C, Mao H J. All-in-one multiple extracellular vesicle miRNA detection on a miniaturized digital microfluidic workstation. Biosensors & Bioelectronics 270 (2025) 116976.
外泌体资讯网 Biosens Bioelectron|中科院上海微系统所毛红菊:用于细胞外囊泡来源miRNA检测的小型全集成数字微流控工作站