尽管在肿瘤切除、化疗和放疗等多种治疗方法上取得了进展,四级胶质母细胞瘤(GBM)患者的总体生存率仍然极为低下(平均生存时间不到2年)。脂质代谢的改变增加了脂肪酸合成,从而导致GBM的放射治疗抗性。来自德国慕尼黑亥姆霍兹生物与医学影像研究所的研究人员探讨了临床批准的降脂药物非诺贝特(FF)在不同GBM细胞系(U87、LN18)中的放射治疗的不同敏感性,揭示了FF与放疗联合使用时在脂质代谢不同的GBM细胞系中的作用机制。该研究确定了大脂滴作为LN18肿瘤细胞中放疗抗性的介导因素,通过细胞外囊泡递送改变FF的递送系统可以克服这种放疗抵抗。相关内容以“Radiosensitizing capacity of fenofibrate in glioblastoma cells depends on lipid metabolism”为题在线发表于12月2日的国际知名氧化还原生物学学术期刊Redox Biology杂志上。
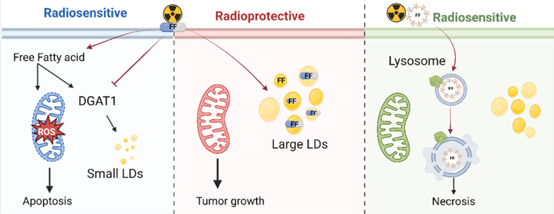
胶质母细胞瘤(GBM)是最常见的原发性脑肿瘤类型,预后极差,生活质量下降。尽管治疗方案的进展改善了结果,但GBM的中位生存期仍然极为低下(10-20个月),这主要是由于其高复发潜力和治疗抗性的发展。放疗(RTx)与烷基化剂替莫唑胺(TMZ)联合使用是GBM治疗的主要支柱方法之一,通常在肿瘤切除手术后进行。放疗通过直接或间接产生活性氧(ROS)来诱导DNA损伤。与全身化疗不同,放疗是局部施加于肿瘤,但周围正常组织限制了其剂量。此外,放射抗性是一个重大挑战,因为肿瘤细胞会适应辐射引起的变化并获得对辐射损伤的抵抗力。放射治疗抵抗主要由DNA损伤修复、细胞周期停滞、肿瘤微环境(TME)的变化、癌症干细胞的生成以及肿瘤细胞代谢的改变(例如,瓦尔堡效应和脂质代谢)引起。由于脂肪酸(FAs)的增加与鼻咽癌、乳腺癌和甲状腺癌中的放射抗性相关,脂质代谢作为癌症的一个标志物的研究日益增长。通过脂肪酸合成酶(FASN)进行的新生脂肪酸合成或通过TME的外源性脂质摄取(例如通过CD36受体)产生的FAs为肿瘤细胞的快速生长提供能量。尽管FAs在不同细胞过程中的重要作用,过量的FAs会对细胞造成伤害并导致脂毒性。因此,过量的游离FAs在转化为三酰甘油(TAG)后被包装成内质网(ER)表面的脂滴(LDs),这一过程由包括二酰甘油O-酰基转移酶(DGATs)和甘油-3-磷酸酰基转移酶(GPATs)在内的多种脂质合成酶促进。除了储存功能外,LDs在细胞应激(例如,ER、氧化和营养应激)、线粒体功能障碍以及能量和氧化还原失衡期间也充当细胞质伴侣。此外,LDs通过减弱辐射引起的细胞应激反应,导致放疗失败。抗高胆固醇和抗高脂血症药物如他汀类和纤维酸类药物可以诱导GBM中的细胞凋亡。此外,FDA批准的降脂药物非诺贝特(fenofibrate,FF)通过激活过氧化物酶体增殖物激活受体α(PPAR α)具有降脂作用。尽管FF已被证明具有一些抗癌活性,但其与放疗联合使用对GBM的辐射反应(例如,通过脂质代谢调节放射敏感性)的影响尚未被探索。早期研究表明,GBM细胞中的高脂质代谢可以引发对脂溶性药物(如TMZ)的抗性,并抑制其治疗效果。为了改善其疗效,脂溶性药物如TMZ或FF可以被封装在生物仿生纳米载体(例如,外泌体和细胞外微囊泡)中,以改变其摄取途径和细胞内通路,并打破由改变的脂质代谢引起的抗性机制。此外,这些纳米载体可以减少游离药物的全身副作用,并克服生物屏障,如血脑屏障。肿瘤膜来源的细胞外囊泡(CmEVs)具有广泛的功能性细胞膜受体和蛋白质,已被用于延长药物的循环时间,并在TME中实现同源靶向积累和药物释放,与合成的有机和无机纳米载体相比,副作用最小。使用CmEVs作为FF的载体是有吸引力的,因为其源自生物细胞膜的生物仿生特性可以最小化炎症和同源相互作用的风险,并促进与放疗的整合,从而实现高效的癌症治疗。为了开发更有效的GBM肿瘤放疗方法,本研究探讨了FF作为放射治疗增敏剂的潜力,既作为游离药物,也作为封装在生物仿生脂质纳米颗粒(CmEVs)中的药物。结果显示,在不同GBM细胞系(U87、LN18)中,FF(50 μM)通过诱导氧化应激造成DNA双链断裂并损害线粒体膜完整性,显著增强了U87细胞的放射敏感性,但通过减少活性氧(ROS)的产生和稳定线粒体膜电位,保护了LN18细胞。比较蛋白质和脂质分析揭示了两种GBM细胞系之间显著的差异:LN18细胞的脂肪酸(FA)簇蛋白转运体CD36的膜表达密度显著高于U87细胞,甘油-3-磷酸酰基转移酶4(GPAT4)的表达更高,支持大脂滴(LDs)的产生,而二酰甘油O-酰基转移酶1(DGAT1)的表达较低,调节小脂滴的形成。因此,大脂滴主要存在于LN18细胞中,而小脂滴则存在于U87细胞中。在FF和辐射的联合处理后,放射治疗抗性LN18细胞中的大脂滴数量显著增加,而放射敏感U87细胞中的小脂滴数量减少。FF在LN18细胞中的放射治疗保护效应可能与大脂滴的存在有关,这些大脂滴作为脂溶性药物FF的储存库。为了防止大脂滴对FF的摄取并改善其作为放射敏感剂的功能,FF被封装在生物仿生细胞膜外源性脂质囊泡(CmEVs)中,这改变了药物的细胞内运输。与游离药物相比,CmEV封装的FF主要富集在溶酶体区,导致通过损害溶酶体膜完整性引起细胞坏死。由于应激诱导的热休克蛋白70(Hsp70)的存在维持了质膜和溶酶体膜的稳定性,而Hsp70对肿瘤特异性糖鞘脂具有强亲和力,因此坏死主要发生在LN18细胞中,这些细胞的膜Hsp70表达密度低于U87细胞。总之,研究结果表明,肿瘤细胞的脂质代谢可以影响FF的放射治疗的敏感性,无论FF是作为游离药物还是作为装载在生物仿生脂质囊泡中的药物。参考文献:Radiosensitizing capacity of fenofibrate in glioblastoma cells depends on lipid metabolism. Redox Biol. 2024 Dec 2;79:103452.




