mRNA被包裹在脂质纳米颗粒(LNPs)中,作为一种新的疫苗形式,被用来诱导针对COVID-19的免疫反应,并开启了疫苗开发的新纪元。近日,MD Anderson Cancer Center的Raghu Kalluri 研究组在J Control Release杂志上发表文章,报告了一种新型、易于执行且具有成本效益的工程化细胞外囊泡(EVs)平台,该平台结合了mRNA和蛋白质疫苗(称为EVX-M+P疫苗),并在癌症和传染病的免疫概念验证研究中探索其效用。
细胞外囊泡(EVs)是由几乎所有类型的细胞分泌的小囊泡。EVs主要分为两种亚型:外泌体和胞质膜微泡,其具有由内体途径或直接从质膜出芽生成的脂质双层结构。外泌体通常来源于内体途径,直径约为40至160纳米,而胞质膜微泡则通过细胞膜直接外向出芽形成,其直径范围约为50纳米至1微米。虽然EVs的确切生理功能尚不完全清楚,但被认为在细胞间的货物转运(如DNA、RNA、脂质、蛋白质和代谢物)以及细胞内通讯中发挥作用。EVs的生物相容性使其在治疗性负载物的体内递送中具有优势,可用于不同疾病的治疗。例如,装载癌症抗原肽的树突状细胞(DCs)来源的EVs已经被用于治疗黑色素瘤和非小细胞肺癌,并显示出抑制肿瘤生长的效果。此外,EVs还可以成功递送针对癌症致癌基因的小干扰RNA(siRNA)和微小RNA(microRNA)。
近年来,装载癌症抗原的EVs作为治疗性疫苗引起了广泛关注。例如,针对乳腺癌的就地DCs激活疫苗已经被开发,同时一种针对B16-OVA肿瘤模型的EV(OVA)疫苗被设计用于重新极化巨噬细胞。在预防性疫苗的背景下,用胚胎干细胞来源的EVs结合粒细胞-巨噬细胞集落刺激因子(GM-CSF)进行疫苗接种,可减少Lewis肺癌荷瘤小鼠的肿瘤负担。此外,将来源于免疫死亡癌细胞的EVs与MART-1肽和CCL22 siRNA修饰后用于小鼠疫苗接种,能够刺激抗原呈递和T细胞反应,从而延缓肿瘤生长,并与胰腺癌的化疗产生协同作用。这些研究表明了工程化EVs在抗原呈递和作为疫苗方面的潜力。
基于EVs在不同疾病背景下广泛的应用及其成功的治疗实施,该研究旨在开发一个易于执行的EVs疫苗平台,在该平台中,可以将驱动疾病的抗原加载到EVs中,并进行概念验证研究。在该平台的设计中,结合了蛋白质疫苗和mRNA疫苗,因为它们能够触发强大的适应性免疫反应。为了验证这种基于EVs的疫苗平台(EVX-M+P)的有效性,该研究评估了嵌入两种不同抗原的EV疫苗的免疫反应:一种是作为模型抗原的卵白蛋白(OVA),另一种是SARS-CoV-2的S蛋白。OVA作为癌症免疫治疗的模型抗原被广泛使用,特别是在与佐剂或纳米疫苗递送方式结合使用时。OVA的分离、结构及氨基酸序列早已确立,使其在早期的抗体生成研究中得以应用。此外,OVA抗原呈递机制、OVA肽表位以及体液和细胞免疫反应也得到了充分的研究。因此,该研究采用与EV相关的OVA作为一种模型疫苗接种策略,以评估其在癌症预防中的可行性和有效性。该研究假设EVs可以被工程化以通过多种抗原诱导抗原特异性的免疫反应。
严重急性呼吸综合征冠状病毒2(SARS-CoV-2)被确认是引发COVID-19大流行的病毒。S蛋白是SARS-CoV-2的四种结构蛋白之一,通过其受体结合域(RBD)与细胞表面受体血管紧张素转换酶2(ACE2)结合,从而使病毒附着于细胞表面并将病毒基因组释放到宿主细胞质中,这使其成为病毒宿主特异性的重要组成部分。迄今为止,EVs在针对SARS-CoV-2的治疗潜力方面进行了研究,重点是利用携带ACE2的EVs作为纳米诱饵以中和病毒。由于S蛋白的宿主特异性以及其产生中和性抗体以防止病毒进入细胞的潜力,S蛋白被用作抗体生成和疫苗开发的目标。然而,据报道,野生型S蛋白不稳定。在S蛋白中986和987位点之间的两丙氨酸(2P)氨基酸替换可以通过防止S1和S2亚基之间的切割来稳定其亚稳态结构并延长其半衰期。此外,已知预融合稳定化的S蛋白比野生型形式更具免疫原性。
该研究开发了一种基于EV的疫苗平台(EVX-M+P),其中X可以是任何与传染病或癌症相关的抗原,M+P代表抗原蛋白和可递送至靶细胞并可能被翻译为额外抗原蛋白的mRNA的组合。具体而言,该研究展示了这种基于EV的平台在以下两种情况下产生保护性体液和细胞适应性免疫反应的能力:EVOvaM+P递送OVA以及EVSpikeM+P递送经过2丙氨酸替换修饰的S蛋白(S(2P)-蛋白)。
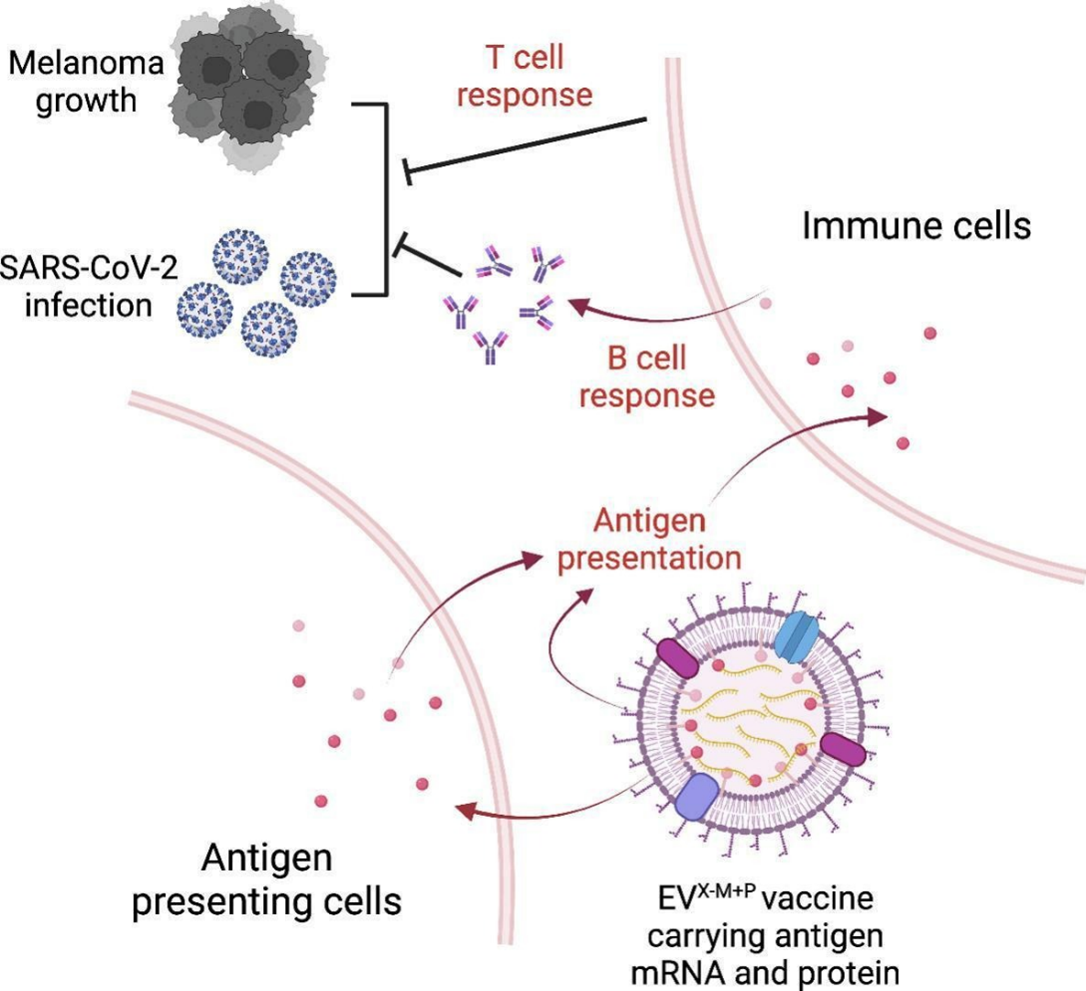
作为第一个例子,该研究将细胞外囊泡(EVs)——一种由所有细胞分泌的天然纳米颗粒载体——设计为包含卵白蛋白mRNA和蛋白质(称为EVOvaM+P疫苗),用于针对卵白蛋白表达的黑色素瘤肿瘤的癌症疫苗。将EVOvaM+P疫苗给予患有已建立的黑色素瘤肿瘤的小鼠,结果显示肿瘤缩小,并伴随有效的体液免疫和适应性免疫反应。
作为第二个例子,该研究构建了包含Spike(S)mRNA和蛋白质的工程化EVs,作为一种结合mRNA和蛋白质的疫苗(称为EVSpikeM+P疫苗),用于针对SARS-CoV-2感染的免疫防护。在小鼠和狒狒中接种EVSpikeM+P疫苗后,诱导了针对S蛋白受体结合域(RBD)的中和性IgG抗体的强效生成,并触发了S蛋白特异性的T细胞反应。
该研究的概念验证研究描述了一种新的平台,该平台利用EVs实现了快速开发结合mRNA和蛋白质的疫苗的能力,可用于对抗癌症和其他疾病的应用。
外泌体资讯网 【J Control Release】工程化细胞外囊泡疫苗平台用于联合递送mRNA和蛋白质以诱导功能性免疫





