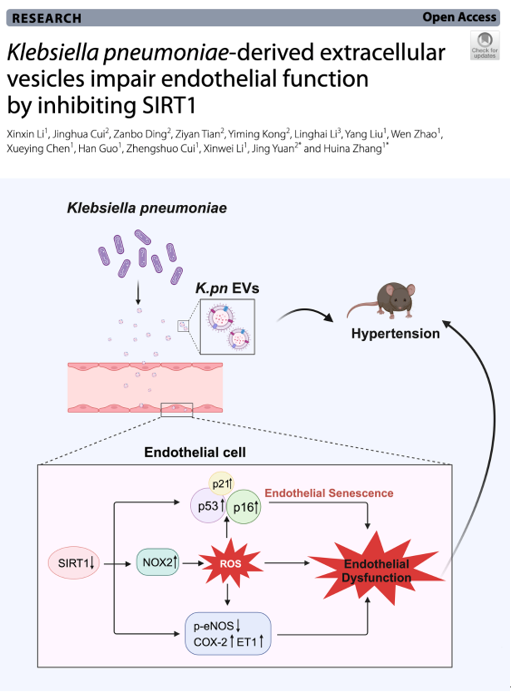
近年来,大量肠道微生物宏基因组研究发现高血压患者肠道菌群的丰度、多样性与组成存在显著差异。肠道菌群的改变进而通过改变细菌代谢物,肠脑轴,肠肾轴,激活免疫炎症系统等多种方式影响血压稳态。因此,粪菌移植也成为高血压潜在的治疗手段。在高血压相关的特定肠道微生物特征谱中,肺炎克雷伯氏菌(K.pn)单菌的增加就能显著促进正常小鼠血压升高,但机制尚未阐明。内皮依赖的血管舒张功能障碍是高血压发生发展的重要病理基础。探索K.pn对内皮功能的影响及机制将为高血压的临床治疗提供潜在的线索和靶点。近日,首都医科大学附属北京安贞医院张慧娜教授团队与首都儿科研究所袁静教授团队在Cell Communication and Signaling期刊上发表了题为"Klebsiella pneumoniae-derived extracellular vesicles impair endothelial function by inhibiting SIRT1"的论文(2025 Jan 13;23(1):21),该研究首次报报道了肺炎克雷伯氏菌分泌的细胞外囊泡(K.pn EVs)被血管内皮细胞摄取后对血管内皮细胞依赖的血管舒张功能的影响及机制。李欣欣博士为第一作者,张慧娜教授和袁静教授为论文通讯作者。
细菌外膜囊泡(BEVs)是革兰氏阴性细菌细胞膜释放的纳米级囊泡,能够穿透损伤的肠道屏障并迁移至不同组织。作为细菌与宿主细胞间通讯的重要介质,BEVs通过运输细菌物质(如胞质蛋白、LPS、毒素、核酸等)调节宿主细胞功能。K.pn是一种革兰氏阴性病原菌,常见于人类胃肠道,且在免疫系统受损者中易引发细菌感染。基于三组独立队列的Meta分析也证实了K.pn在高血压患者肠道中的富集。已有研究表明,K.pn的增殖与炎症性肠病相关,且与非酒精性脂肪肝病和多发性骨髓瘤进展有关。此外,体内实验表明,K.pn能促进血管收缩、血压升高,但具体机制尚未明确。研究团队通过动物和血管组织的在体和离体研究,以及细胞学和相关蛋白的分析,探讨了K.pn EVs对内皮细胞衰老,氧化应激以及血管依赖的舒张功能的影响及其机制。研究发现,K.pn显著损害乙酰胆碱诱导的内皮依赖性舒张,并增加超氧阴离子的生成, 促进内皮细胞衰老。体内与离体实验均表明,K.pn EVs能导致小鼠血压升高,减弱主动脉内皮依赖的舒张功能,加速内皮细胞衰老,并通过抑制SIRT1表达增加超氧阴离子的产生。进一步研究表明,K.pn EVs降低了内皮细胞中SIRT1和p-eNOS的水平,且增加了NOX2、COX-2、ET-1与p53的水平。值得注意的是,SIRT1的过表达或激活能够缓解K.pn EVs对内皮细胞的不利影响,并改善相关蛋白的变化。这项研究首次从细菌细胞外囊泡角度阐明肠道菌导致高血压的可能机制,为K.pn引起高血压发病机制提供了新的解释,拓展和深化了对肠道菌群影响内皮功能和高血压的理解,并为潜在的治疗靶点与临床干预策略的探索奠定了基础。参考文献:Klebsiella pneumoniae-derived extracellular vesicles impair endothelial function by inhibiting SIRT1. Cell Commun Signal.2025 Jan 13;23(1):21. doi: 10.1186/s12964-024-02002-0
外泌体资讯网 Cell Commun Signal|北京安贞医院张慧娜/首都儿科研究所袁静:肺炎克雷伯菌来源EV抑制SIRT1 损害内皮功能