细胞外囊泡(EVs)在调节恶性肿瘤的发生、进展、存活和转移等方面发挥着重要作用。近年来,越来越多研究从不同层次揭示了EVs在肿瘤耐药中功能。然而,EVs摄取路径对肿瘤细胞耐药表型作用却被忽视了。
近日,南开大学医学院张思河教授课题组在Drug Resistance Updates(5年IF=18.1,中科院1区)杂志上发表题为“The uptake of extracellular vesicles: Research progress in cancer drug resistance and beyond”综述文章,系统地更新总结了不同EVs亚型、生物学基础和细胞摄取机制,重点阐述了EVs内吞路径如何影响肿瘤不同耐药表型,提出针对性靶向EVs内吞路径克服肿瘤耐药潜在策略,展望讨论了这一领域研究空白。南开大学医学院博士研究生钱罗蒙为第一作者,张思河教授为通讯作者。
越来越多研究表明,EVs摄取对促进肿瘤耐药性十分重要。首先,供体肿瘤细胞可将作用药物通过EVs包装并分泌排出,从而增强肿瘤细胞的耐药性。其次,细胞间传递的EVs被受体细胞摄取后,其特定内容物如非编码RNA和特定功能蛋白或信号分子能够促进肿瘤细胞耐药性。此外,EVs摄取能够调节受体细胞内转录与代谢活动,触发癌基因激活和致癌信号,诱导肿瘤细胞各种恶性行为,从而增强受体细胞的耐药性。不同细胞可以通过不同方式摄取EVs:包括非内吞路径摄取、网格蛋白介导内吞(CME)、小窝蛋白依赖内吞(CDE)、脂筏介导内吞、巨胞饮、吞噬作用和穿胞作用。EVs摄取过程是否取决于受体细胞类型和EVs表面具体组份,以及EVs摄取如何决定肿瘤细胞不同恶性表型,特别是肿瘤耐药表型目前尚不完全清楚。该综述整理了目前已知EVs所有亚型,分析了EVs摄取的生物学基础,并重点阐述了EVs摄取如何介导肿瘤耐药表型。
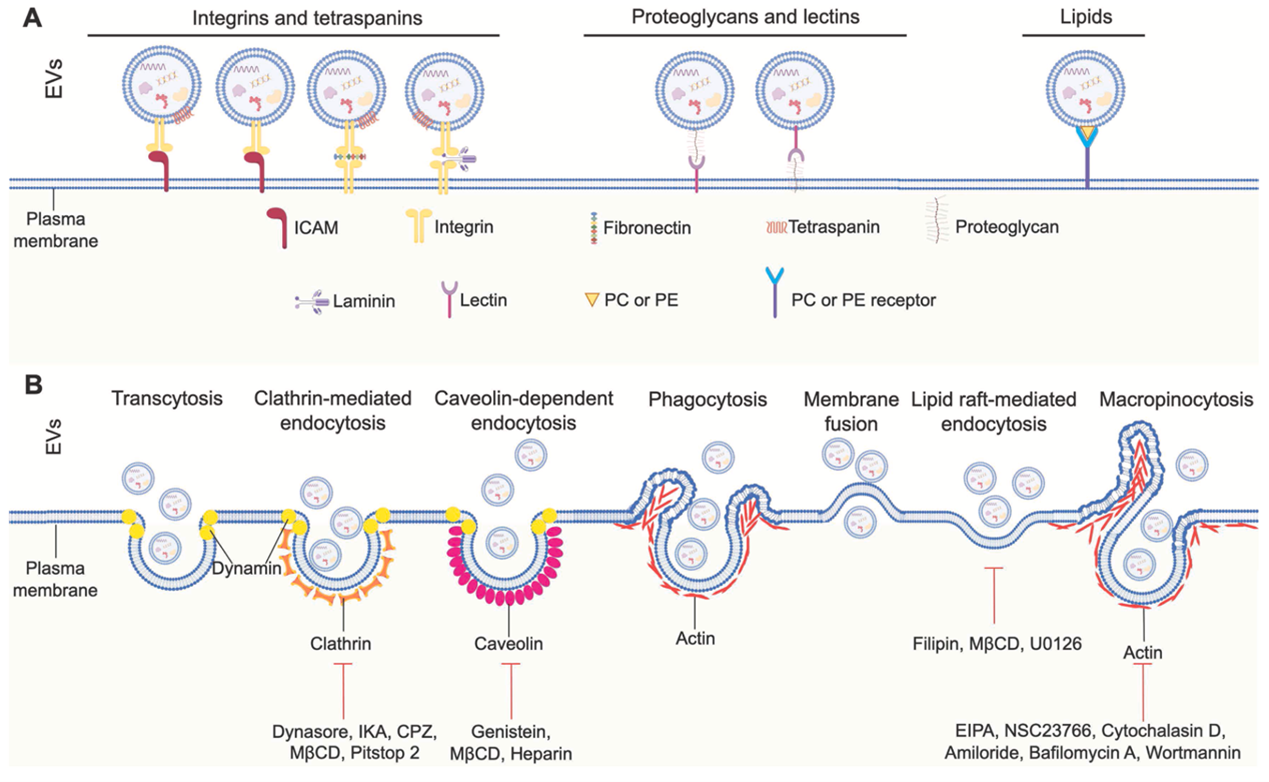
图1:EVs生物学识别基础和细胞摄取路径。(A)几种关键配体-受体或功能蛋白促进EVs在受体细胞识别和对接。(B)EVs的不同细胞摄取途径。
近年新发展的EVs精细标记、体内活体成像、高分辨动态细胞成像及交叉应用技术促进了在不同应用场景下检测细胞摄取EVs的可能。膜桥接分子理论可以解释EVs摄取前与受体细胞的精准识别和精细对接。不同种类EVs在不同细胞的摄取机制表现出相当复杂的多样性。CME、CDE、脂质筏介导内吞、巨胞饮和吞噬作用是目前报道的驱动EVs摄取的主要细胞内吞路径。不同类型EVs的摄取可以促进功能性核酸、特定蛋白和代谢物向受体细胞内递送。这些核酸、白质和代谢分子常上调细胞关键致癌和存活信号机制,并促进肿瘤免疫抑制微环境的形成。这些发现说明EVs摄取对肿瘤细胞多药耐药起关键作用,针对性靶向EVs具体内吞路径可成为克服肿瘤耐药的潜在策略。
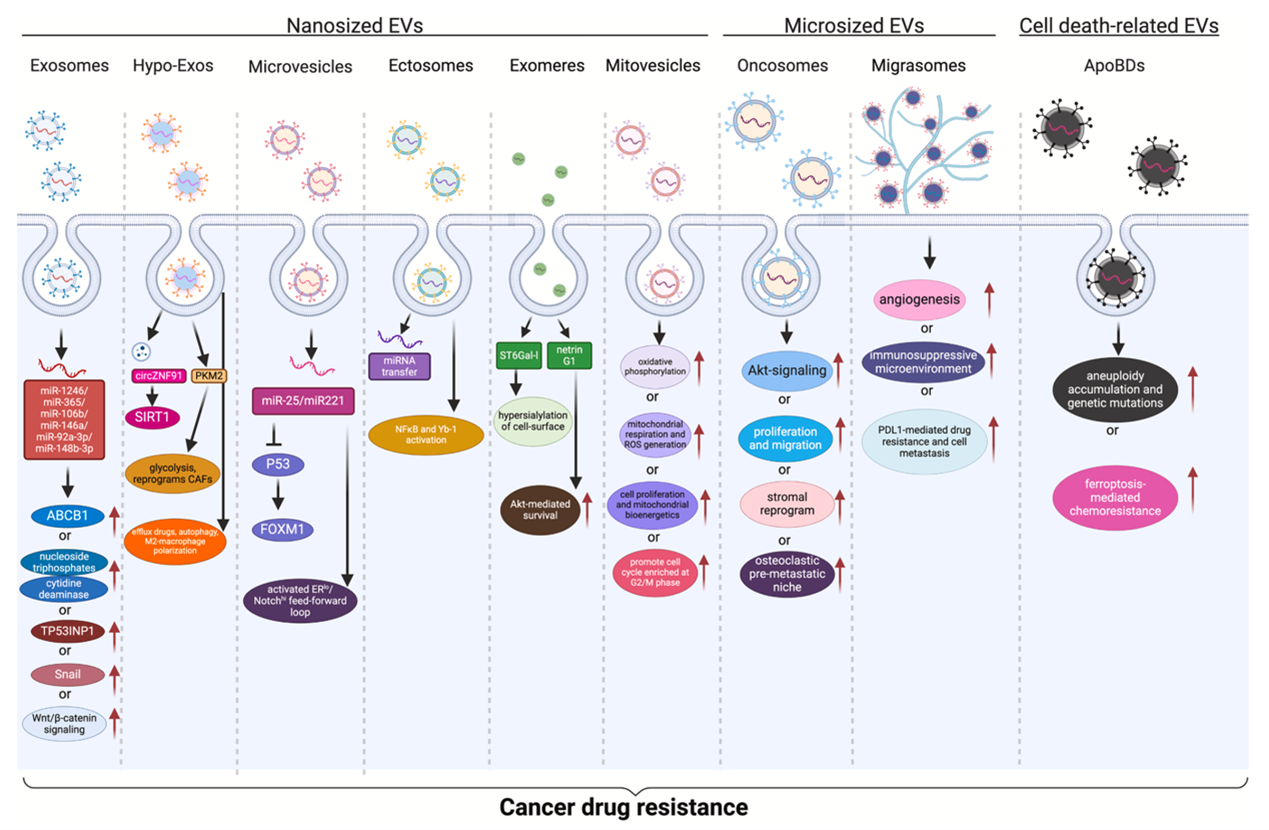
图2:不同类型EVs摄取介导肿瘤耐药的分子机制
此外,文章还介绍了调节干预EVs摄取相关临床试验研究进展。着重介绍了目前开展的早期临床试验中EVs用作药物寄送纳米载体和抗肿瘤疫苗所利用的EVs摄取策略。
最后,由于许多内吞路径调节剂在体内的药理机制和成药性评价仍处于探索阶段,作者讨论了开展EVs摄取抑制剂逆转肿瘤耐药转化研究的挑战性。受限因素包括但不限于已知内吞路径抑制剂的细胞特异性及内吞抑制剂与临床肿瘤药物联用可能带来的毒性增加问题。因此,作者提出,迫切需要深入研究不同肿瘤中不同种类EVs摄取的细胞内吞调节机制,要研发选择性高安全性强的EVs内吞抑制药物,从而实现精准靶向特定内吞路径来逆转肿瘤耐药的目标。
参考文献:
The uptake of extracellular vesicles: Research progress in cancer drug resistance and beyond, Drug Resistance Updates. 2025 Jan 31:79:101209. doi: 10.1016/j.drup.2025.101209
外泌体资讯网 Drug Resistance Updates|南开大学医学院张思河教授课题组:细胞外囊泡的摄取:在肿瘤耐药与其他方面的研究进展