肠道微生物群失衡被认为是炎症性肠病(IBD)的关键诱因之一,而益生菌因其调节肠道微生物群的潜力,成为IBD治疗的新兴药物。然而,益生菌的临床应用仍面临诸多挑战,例如胃肠道环境对益生菌活性的破坏、单一菌株长期使用可能引发免疫耐受及其在IBD中的复杂作用机制尚未阐明等,这使得开发更高效、持久的益生菌疗法成为亟待解决的难题。最近,细菌胞外囊泡(bEVs)的研究为这一领域带来了新希望。这些囊泡携带了亲本细菌的生物活性成分,如蛋白质、脂类、DNA和RNA,能够绕过胃肠道屏障,直接调节宿主细胞,发挥多种生物学功能。
2025年1月31日,暨南大学第二附属医院/深圳市人民医院消化内科团队在Journal of Nanobiotechnology(IF:10.6,中科院一区)杂志上发表题为“Real-world of Limosilactobacillus reuteri in mitigation of acute experimental colitis”的研究论文(2025 Jan 31;23(1):65),揭示罗伊氏乳杆菌质膜囊泡(L. reuteri-CMVs)用于结肠炎模型的疗效和内在作用机制,为结肠炎治疗提供了新的微生物来源策略。该研究由博士生岳宁宁和博士后赵海兰为共同第一作者,深圳市人民医院姚君教授、王立生教授、李德锋教授等为共同通讯作者。
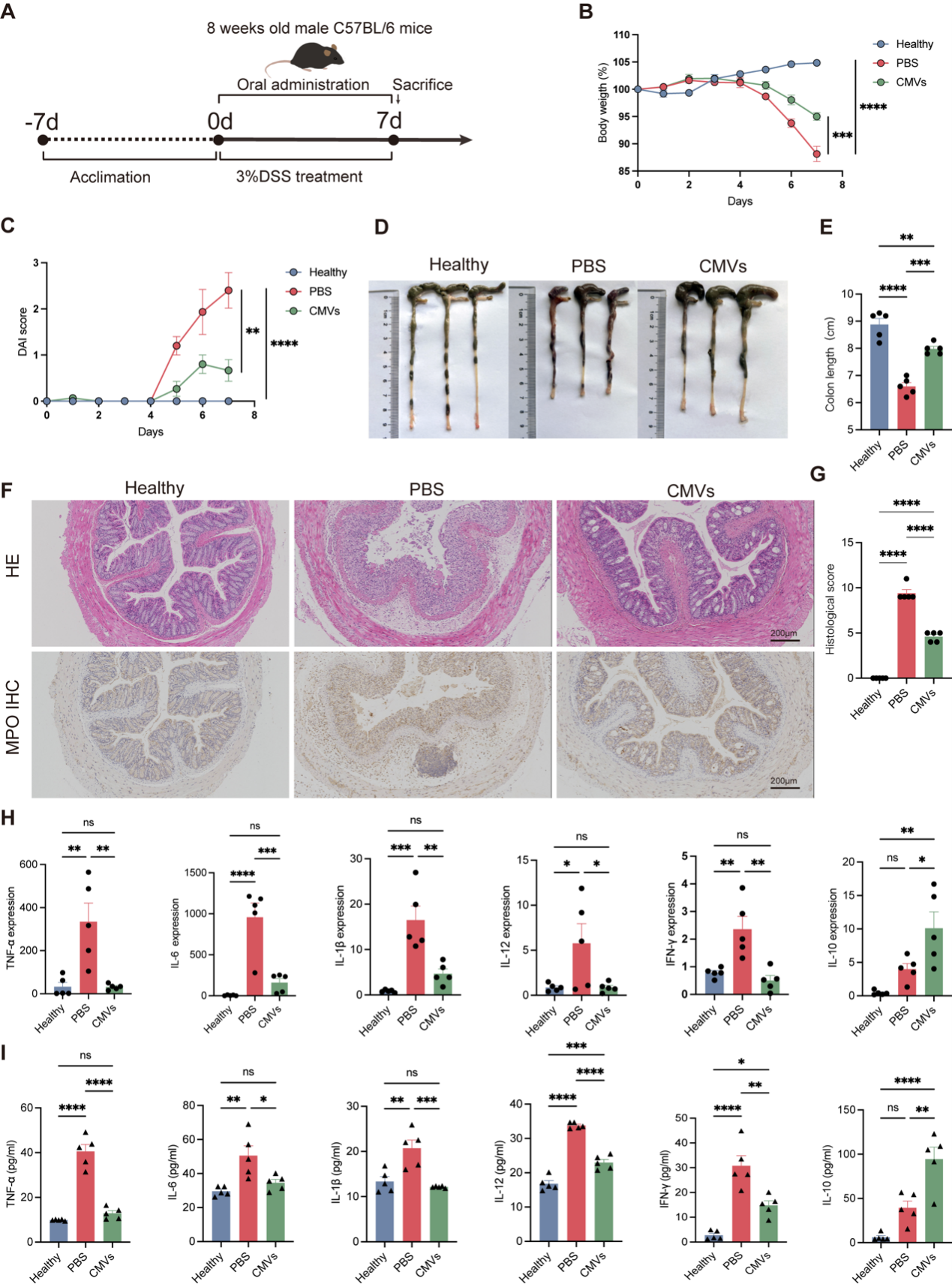
研究团队发现,L. reuteri-CMVs在缓解DSS诱导的急性结肠炎方面表现出显著效果。L. reuteri-CMVs通过以下多重机制发挥作用:
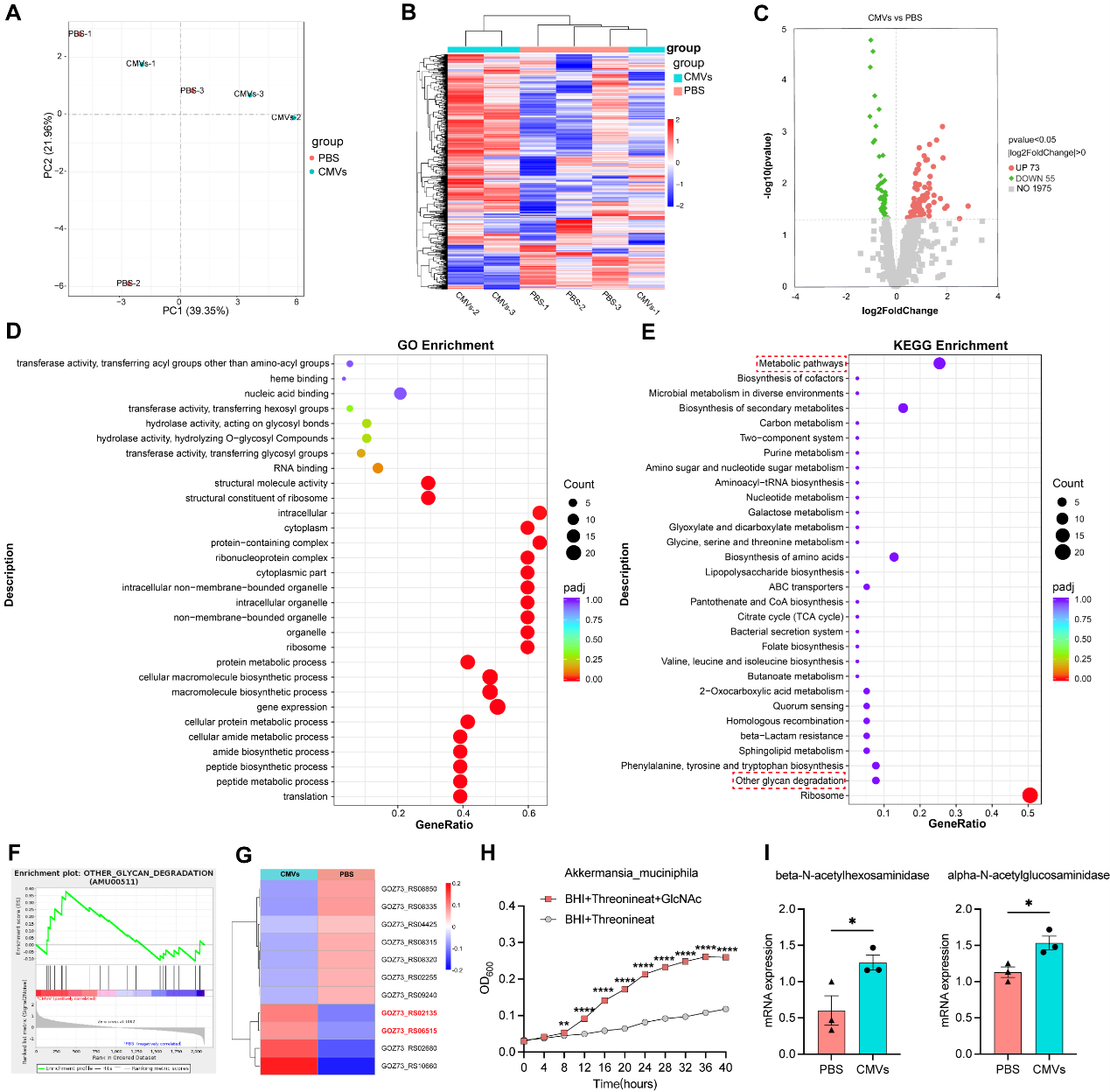
- 恢复肠道菌群平衡:L. reuteri-CMVs可被益生菌Akkermansia muciniphila(AKK)吞噬,通过上调糖苷酶(β-N-乙酰己糖胺酶和α-N-乙酰葡糖胺酶)的表达(糖苷酶通过水解糖胺聚糖(如GlcNAc)中的特定糖残基,帮助AKK获得营养物质)选择性促进AKK的增殖,优化肠道微生态环境,恢复菌群平衡。
- 增强肠道屏障功能:L. reuteri-CMVs可被肠道上皮细胞吸收,显著提高紧密蛋白(ZO-1、E-cadherin和 Occludin)的表达,降低肠道通透性,增强上皮屏障功能。RNA测序分析进一步表明,L. reuteri-CMVs通过激活HIF-1信号通路和上调HMOX1的表达,修复受损的肠道屏障。
- 调节免疫稳态:双阳性(DP)CD4+CD8+T细胞作为肠道调节性免疫细胞,对抑制肠道炎症、维持肠道粘膜稳态和分泌抗炎细胞因子至关重要。L. reuteri-CMVs增加DP CD4+CD8+ T细胞的数量,抑制肠道炎症反应,维持肠道粘膜的免疫平衡。
此外,L. reuteri-CMVs在胃肠道环境中表现出优异的稳定性和安全性,并能特异性靶向结肠炎病变部位,发挥局部治疗作用。
图1 L. reuteri-CMVs减轻DSS诱导的急性结肠炎
图2 L.reuteri-CMVs调控AKK增殖的机制
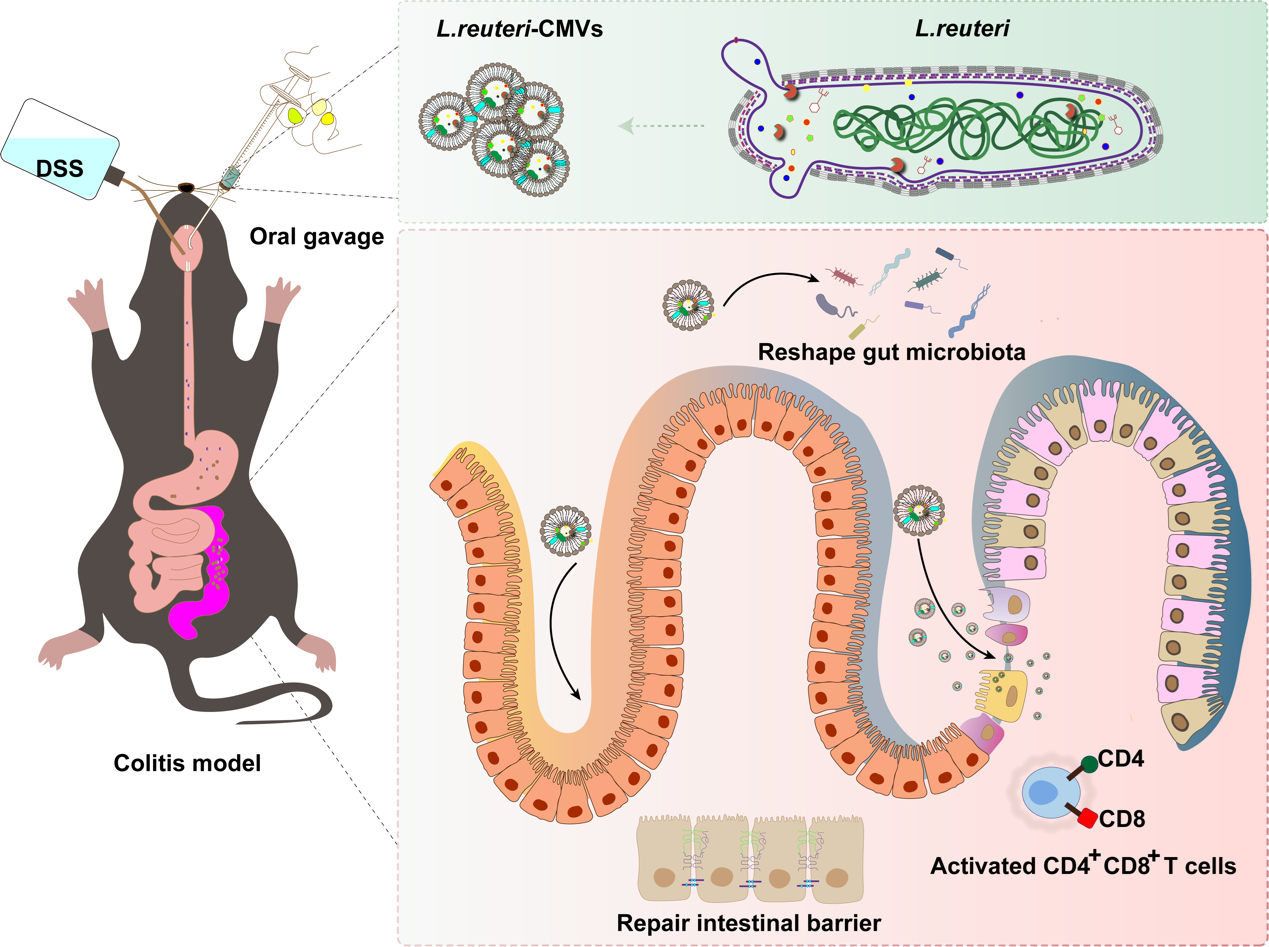
图3 研究概述示意图总之,这项研究不仅揭示L. reuteri-CMVs在结肠炎治疗中的多重机制,还为开发基于益生菌胞外囊泡的新型疗法提供了重要依据。随着进一步的研究,L. reuteri-CMVs有望成为结肠炎患者的新希望,为IBD治疗开辟全新的方向!
参考文献:
Real-world of Limosilactobacillus reuteri in mitigation of acute experimental colitis. Journal of Nanobiotechnology. 2025 Jan 31;23(1):65.DOI: 10.1186/s12951-025-03158-8
外泌体资讯网 J Nanobiotechnology|深圳市人民医院消化内科王立生/李德锋:罗伊氏乳杆菌质膜囊泡在缓解急性结肠炎中的研究