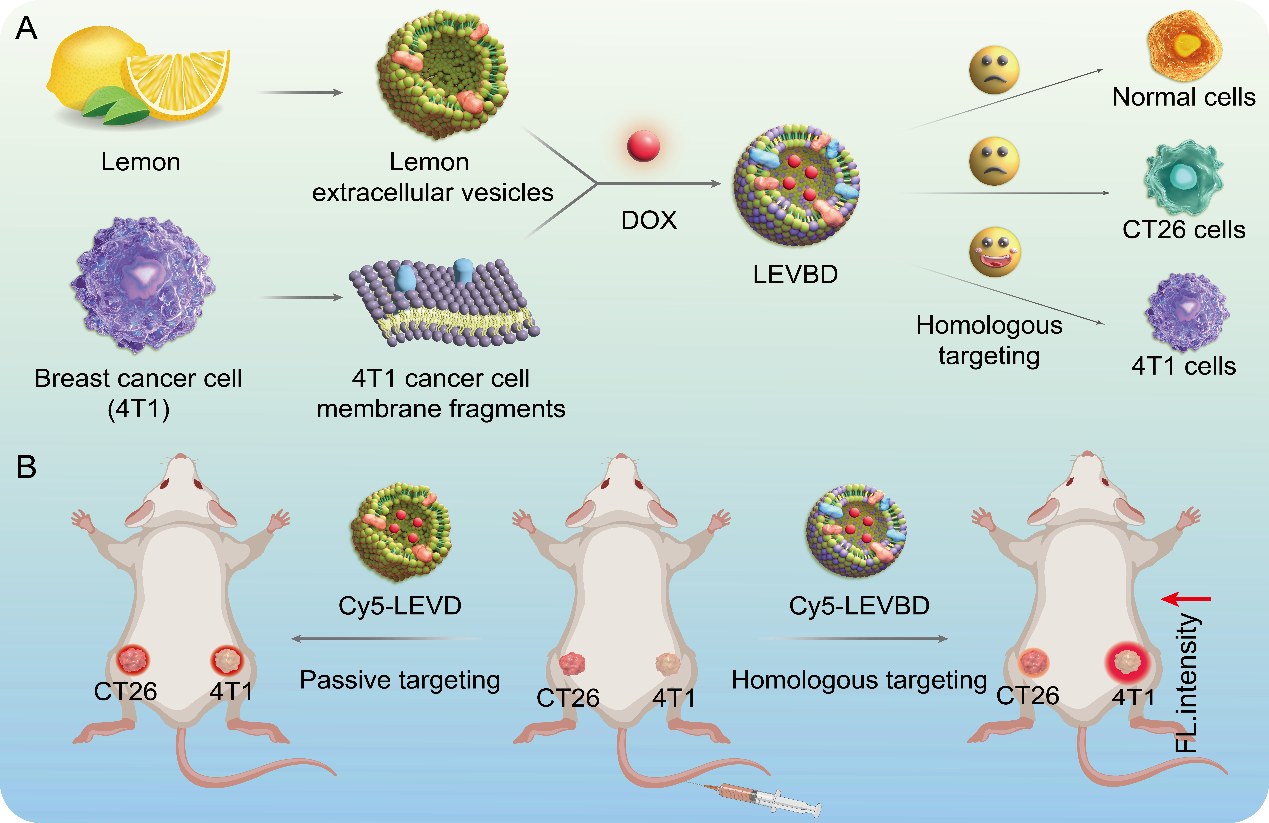
全身给药依赖血管网络实现药物扩散,但化疗药物非特异性分布常引发全身毒性,而提高剂量又加剧副作用。通过特定工程化手段合理设计药物载体对改善药物靶向性、肿瘤耐药性等方面有显著帮助。植物源性细胞外囊泡(PDVs)是一类具有高的生物安全性和成本效益的天然纳米材料,这些囊泡携带核酸、蛋白、小分子等丰富的活性物质用于细胞间物质交换和信息交流,因此植物来源的囊泡用于药物递送具有巨大的发展潜力。然而,当前植物囊泡与细胞靶向相互作用机制仍有待研究,基于植物囊泡构建递药载体的肿瘤靶向性有待提高。近日,湖北中医药大学张国军教授团队在Journal of Nanobiotechnology杂志上发表题为“Enhanced tumor self-targeting of lemonderived extracellular vesicles by embedding homotypic cancer cell membranes for efficient drug delivery”的论文,主要介绍了通过工程化手段构建了基于癌细胞囊泡和柠檬囊泡的杂化纳米囊泡平台用于同源肿瘤识别和高效药物递送。硕士生杨璐瑶为第一作者,张国军教授和李朝卿博士为共同通讯作者。
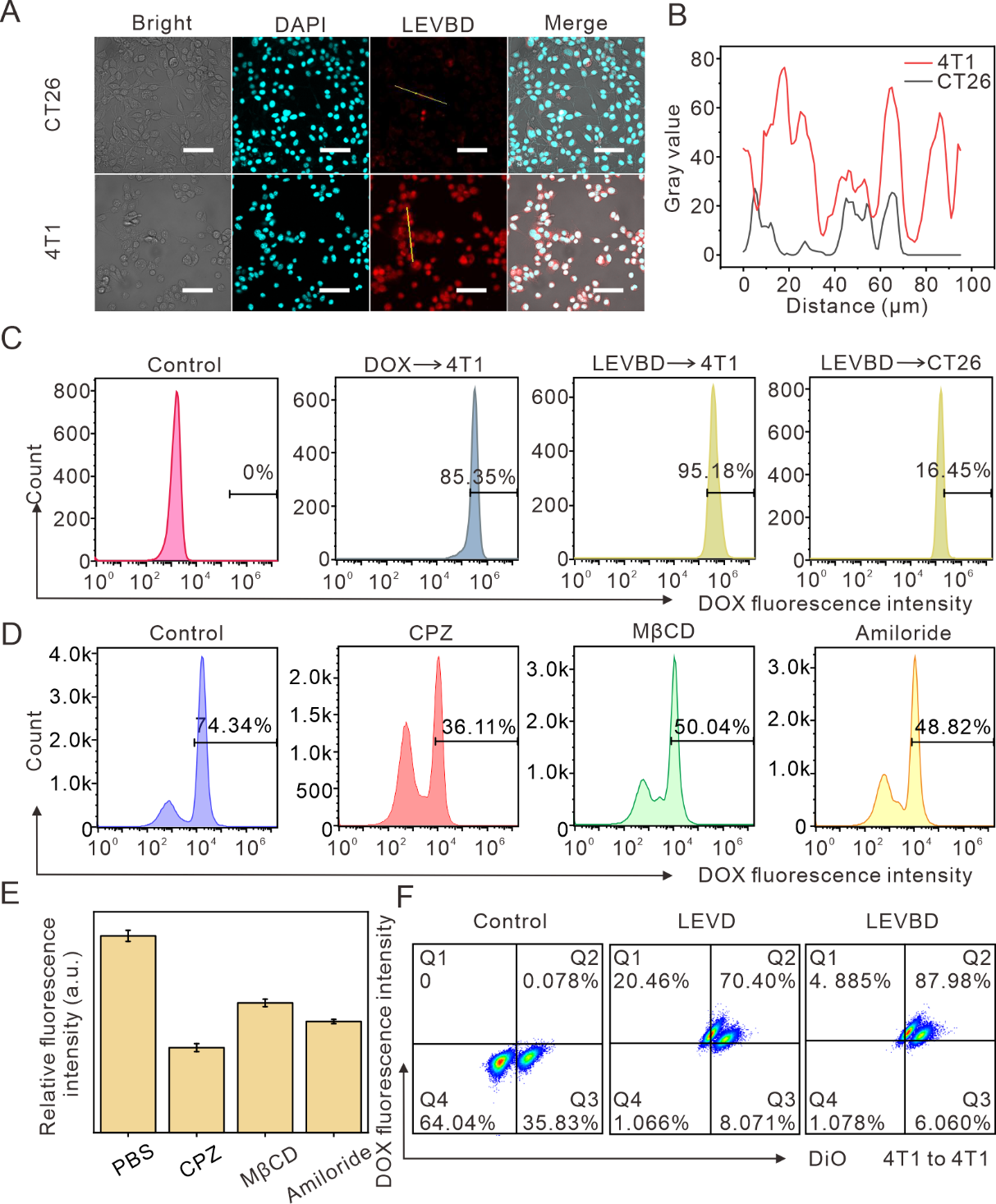
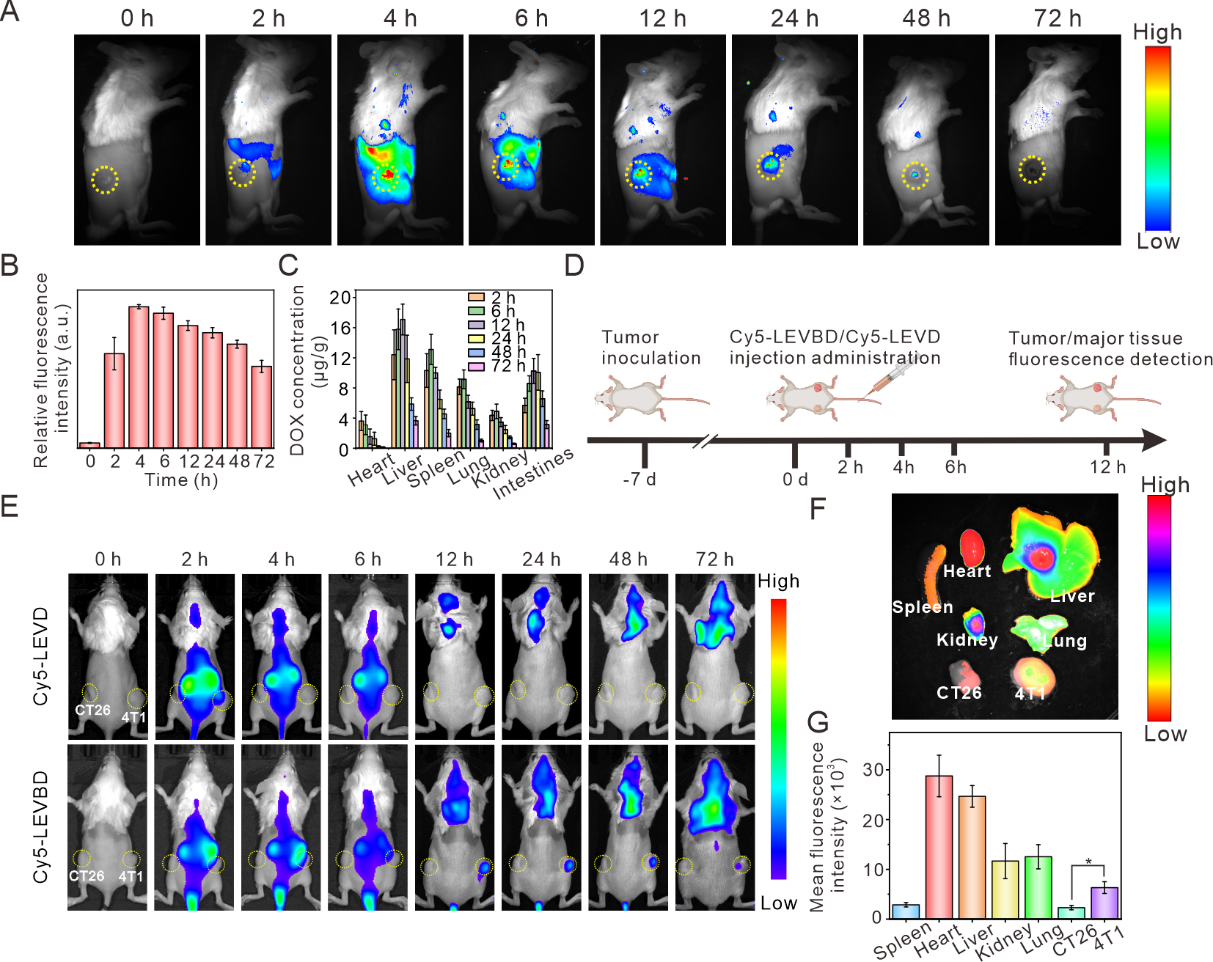
PDVs因其具有较高的成本效益和生物安全性成为新兴的药物递送载体。2024年发布的中草药研究共识为PDVs的研究提供了重要指导。山药、柚子、柠檬等植物来源的囊泡在药物递送中展现出显著潜力。然而,PDVs在体内的分布不确定,难以精准靶向病灶,且人工修饰靶向分子的过程复杂,效率有限。如何构建一类高效靶向肿瘤细胞的囊泡载体对于PDVs的转化应用非常关键。已有研究表明,肿瘤细胞表面的特定蛋白质(如粘着斑蛋白、整合素等)赋予其强大的粘附力,促使肿瘤形成。此外,T抗原介导的同型细胞粘附机制可用于增强纳米颗粒的靶向性。基于以上研究背景,作者将特定癌细胞膜片段与PDVs融合,以赋予PDVs特异性靶向能力。该研究提出跨界膜融合策略:基于肿瘤细胞膜表面粘附蛋白介导的同型识别特性,将4T1乳腺癌细胞膜片段与柠檬细胞外囊泡(LEVs)融合,构建混合纳米囊泡LEVB,并负载阿霉素(DOX)形成LEVBD体系(图1)。该研究通过体外实验验证了LEVBD的同源靶向能力,CT26和4T1细胞分别与LEVBD共孵育4小时后,4T1细胞的红色荧光强度显著高于CT26细胞,且流式细胞术分析显示4T1细胞对LEVBD的摄取率约为95.18%,是CT26细胞的5.7倍。此外,通过不同内吞抑制剂处理后发现LEVBD的摄取存在多条途径。进一步的跨细胞转运实验表明,LEVBD在4T1细胞间的转运效率较高。在单侧4T1荷瘤小鼠模型中,将Cy5标记的LEVBD和LEV分别静脉注射到4T1荷瘤小鼠体内,利用IVIS系统监测其分布。结果显示,LEVBD在注射后6~72小时内肿瘤部位的荧光强度显著高于其他器官,表明其在肿瘤部位的积累量更高。而LEV在48小时内基本代谢完毕,肿瘤部位无明显荧光信号。此外,通过构建双肿瘤荷瘤小鼠模型,发现LEVBD在4T1肿瘤中的荧光强度显著高于CT26肿瘤,表明其具有同源靶向特性。这些结果表明,LEVBD在体内能有效靶向同源肿瘤,即使在异源肿瘤存在的情况下也能实现精准递送。且该载体促进了酸性肿瘤微环境中的可持续药物释放,从而显着抑制肿瘤生长,且没有任何可观察到的毒副作用。该研究通过天然磷脂双层结构的兼容性实现稳定融合,既保留LEVs的生物相容性,又赋予同源靶向能力,规避了肿瘤外泌体活性分子的潜在风险。相较于传统递药载体,该体系通过仿生膜修饰策略有效解决了靶向递送难题,为开发安全高效的植物源纳米药物载体提供了新范式。Enhanced tumor self-targeting of lemon-derived extracellular vesicles by embedding homotypic cancer cell membranes for efficient drug delivery. J Nanobiotechnol. 2025; 23: 74. doi: 10.1186/s12951-025-03161-z.外泌体资讯网 J Nanobiotechnol|湖北中医药大学张国军教授团队:具有肿瘤自我识别能力的杂化柠檬囊泡用于高效药物递送