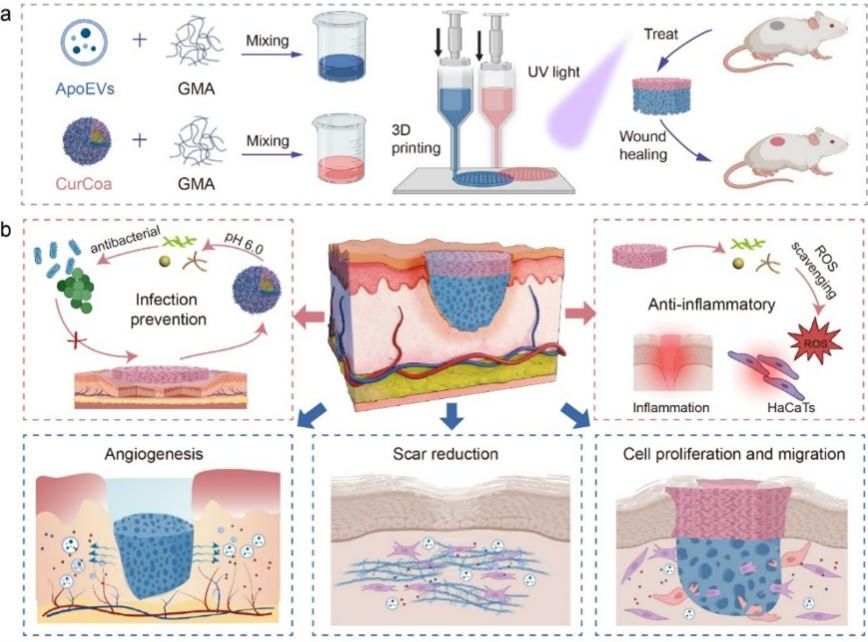
皮肤是人体最大的器官,承担保护、调节和感知等重要功能,但也易受创伤、烧伤等导致的全层缺损困扰。皮肤移植虽是治疗金标准,但面临供体短缺、免疫排斥等挑战。皮肤组织工程为此提供了新思路,而3D生物打印技术更是带来了革命性突破,能够构建个性化支架,精准模拟皮肤结构,为细胞生长和组织再生提供理想环境。将治疗性纳米颗粒整合到皮肤组织工程中,已成为促进伤口愈合和皮肤再生的一种极具前景的策略。其中,脂肪组织来源凋亡囊泡(ApoEVs)携带多种生物活性分子,促进组织再生。凋亡囊泡是细胞凋亡过程中释放的细胞外囊泡,携带多种生物活性分子,如蛋白质、核酸等,具有促进组织再生的能力。脂肪组织作为来源,可能因为其易获取、含有丰富的干细胞或间充质细胞,这些细胞在凋亡时释放的囊泡可能有独特的再生特性;凝聚体(Coacervates)液滴通常指的是一种或多种水溶性大分子在临界浓度以上相互作用,通过液液相分离从水中析出所形成的乳液滴,能够高效负载并保护负载药物,且具有合成简便、结构动态可调等特点,负载天然药物姜黄素后具有抗菌和抗氧化特性,有效清除活性氧,保护伤口免受感染。这些纳米颗粒的独特优势为皮肤再生提供了新的可能。
近期,四川大学刘磊教授、周加境研究员、李蕙助理研究员、刘晓静助理研究员团队受天然皮肤组织结构的启发,开发出一种3D打印的多功能双层支架,相关工作以“3D-printed Multifunctional Bilayer Scaffold with Sustained Release of Apoptotic Extracellular Vesicles and Antibacterial Coacervates for Enhanced Wound Healing”为题发表在Biomaterials上(DOI:10.1016/j.biomaterials.2025.123196),文章第一作者是四川大学博士研究生蒋林利与助理研究员董佳,研究工作受到国家自然基金和四川省自然科学基金的支持。
这款支架结合了具有再生功能的凋亡囊泡(ApoEVs)和有抗菌作用的凝聚体纳米颗粒(Curcoa),并进一步探索了其伤口愈合效果及潜在的愈合机制。上层结构紧密,模拟表皮层,有助于保护伤口免受外界机械力的影响,从支架中持续释放的ApoEVs可促进成纤维细胞的迁移和增殖,以及体外内皮细胞的血管生成;下层孔径疏松,便于细胞迁移和物质交换,具有pH响应性的Curcoa具有抗菌活性和清除胞内活性氧的能力(图1)。体内实验表明,使用此支架治疗后,伤口愈合速度加快,瘢痕组织中的胶原含量和瘢痕厚度显著降低。上调和下调的基因均揭示了双层支架促进伤口愈合的分子机制。该研究为皮肤支架的设计提供了有价值的见解,并为全层皮肤缺损的治疗提供了一个有前景的候选方案。
图1 3d打印双层多功能支架设计及其在伤口愈合中的应用示意图
研究首先制备了ApoEVs和Curcoa纳米颗粒(图2a、b)。凋亡囊泡呈现典型的双膜球状结构,平均尺寸为104.2 ± 5.3 nm,能表达了与凋亡相关的特异性标志蛋白,凋亡标志物磷脂酰丝氨酸呈阳性(图2c-f)。凝聚体纳米颗粒由生物质材料通过水相一锅法制备,平均直径为92.1 ± 4.4 nm,具有ROS清除能力和亲/疏水药物负载能力,并在酸性环境下表现出更快的药物释放速率(图g-j)。
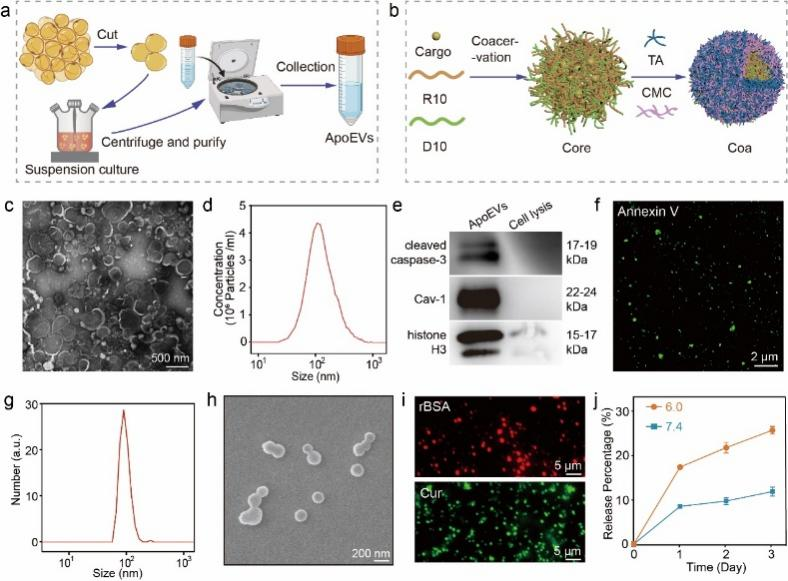
图2 凋亡囊泡和凝聚体纳米颗粒的构建与表征
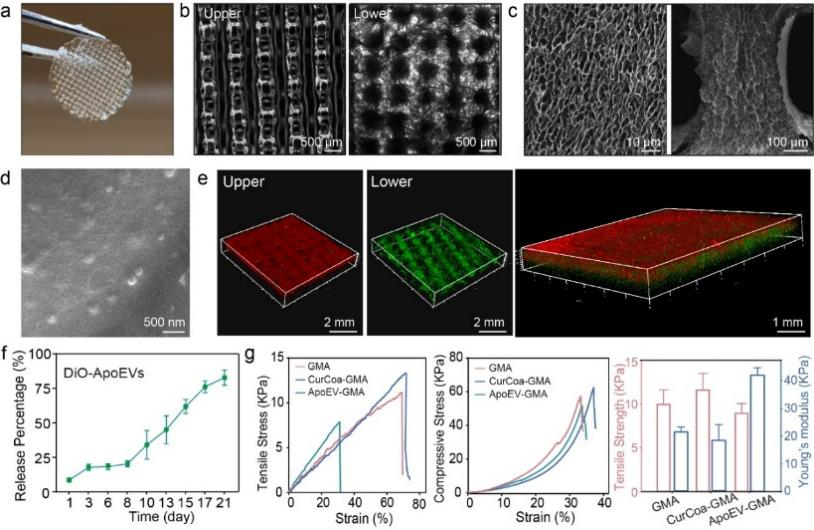
接着,研究采用了甲基丙烯酸化明胶(GelMA,简称GMA)来构建一种结合凋亡囊泡和凝聚体形成仿生支架。显微镜图像显示,支架具有各向异性结构,上层孔隙明显小于下层。这种差异旨在通过上层更致密的结构,以防止外部细菌和污染物侵入伤口,而下层较大的孔隙则有利于细胞浸润和物质交换。扫描电子显微镜图像表明,支架具有高度多孔的结构,提供了细胞浸润增强、营养交换和废物清除等多重优势,这对于组织再生和伤口愈合至关重要(图3a-e)。支架能够在21天内缓慢释放超过75.0%的凋亡囊泡(图3f)。支架的杨氏模量与人体软组织(E = 1–100 kPa)相当(图3g),对于确保与周围组织的兼容性和整合至关重要,使该支架成为皮肤组织工程应用的一个有前途的候选者。
图3 CurCoa-ApoEV-GMA双层支架的表征
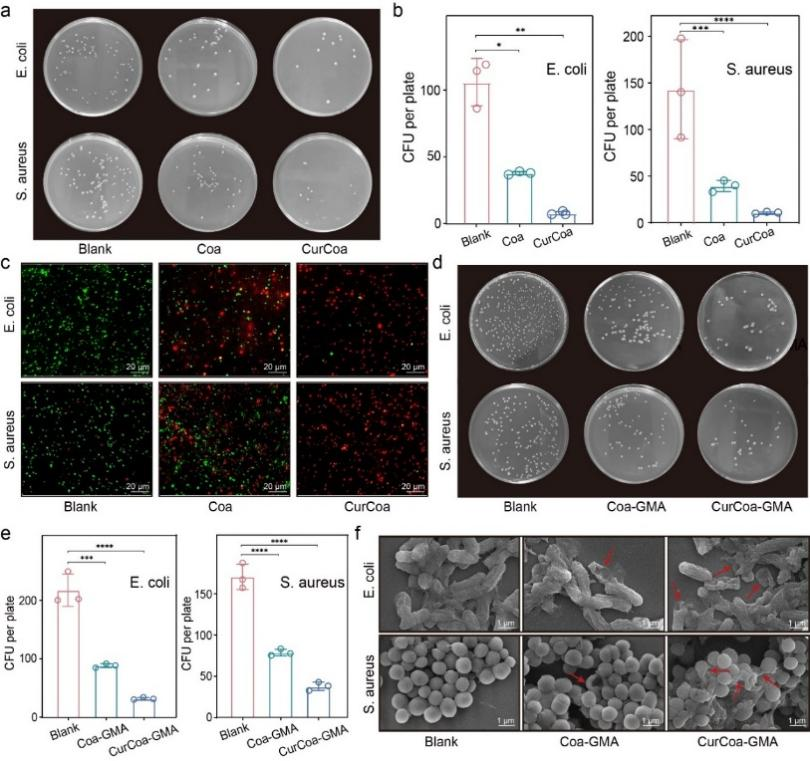
抗菌实验结果表明,Cur-Coa纳米颗粒和上层的CurCoa-GMA支架对金黄色葡萄球菌和大肠杆菌均表现出有效的抗菌活性(图4)。进一步体外研究揭示,CurCoa-ApoEV-GMA支架具有良好的体外生物相容性,Cur-Coa纳米颗粒和上层的CurCoa-GMA支架具有胞内ROS清除能力(图5a、b),下层的ApoEVs和ApoEV-GMA支架能促进细胞迁移、促进血管内皮细胞成管并促进相关细胞增殖,以上结果为进一步的体内实验提供了参考依据(图5c-f)。
图4 Curcoa和CurCoa-GMA支架的抗菌作用
图5 CurCoa-ApoEV-GMA支架对体外伤口愈合的调节作用
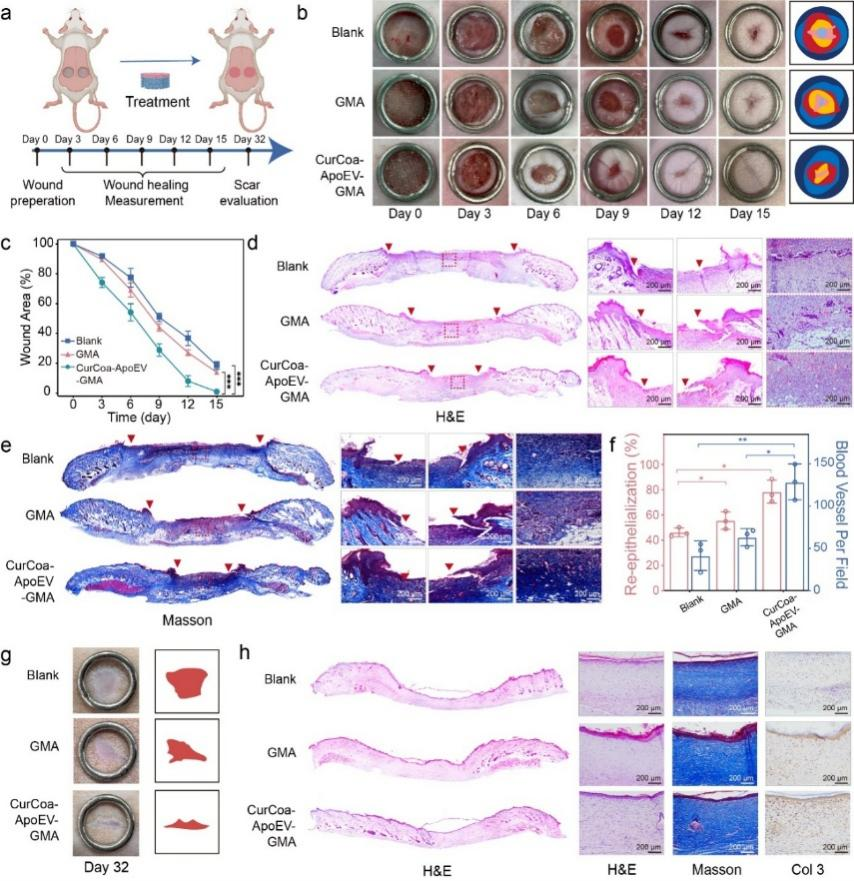
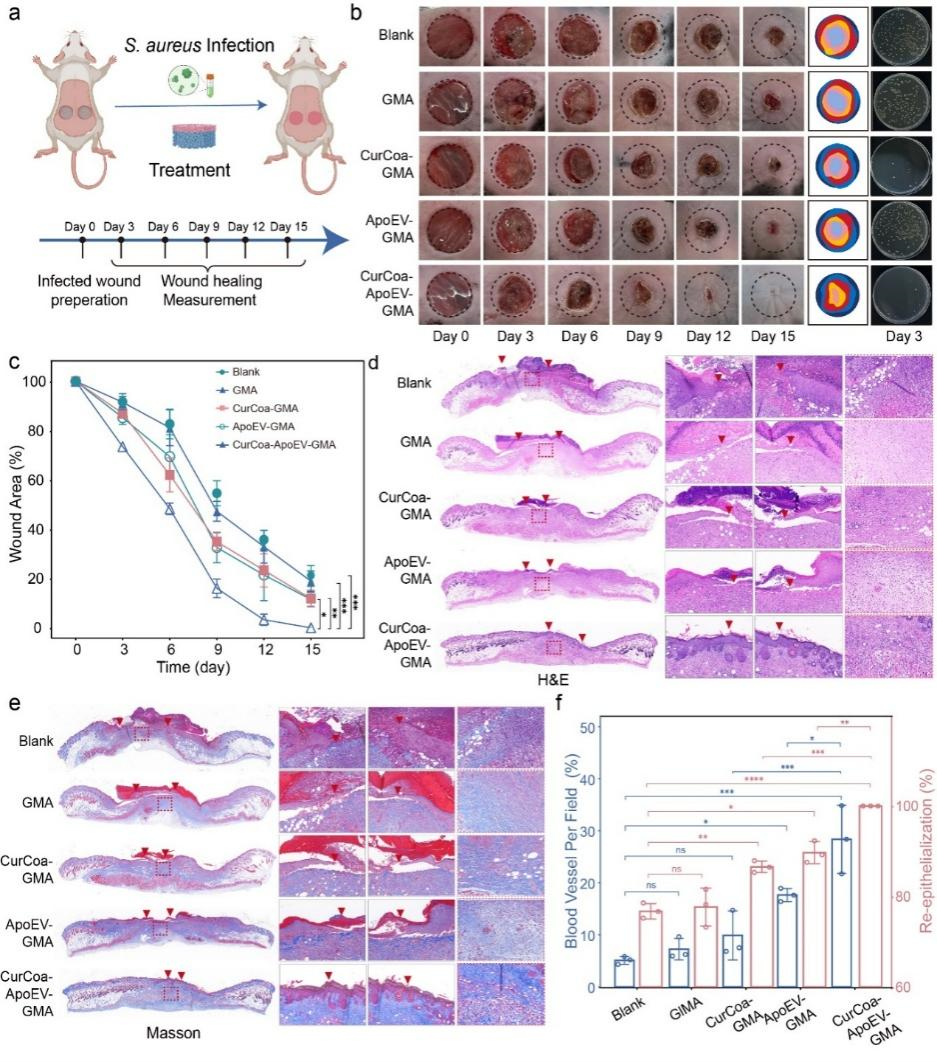
对于普通全层皮肤缺损,CurCoa-ApoEV-GMA支架能促进缺损愈合(图6a-c)。组织学图像显示,支架处理后组织再上皮化速度加快,肉芽组织更厚且成分更多样(图6d-e)。再上皮化率提高,血管数量也更多(图6f)。就长期愈合质量而言,CurCoa-ApoEV-GMA组的皮肤结构更规则,瘢痕区域更窄,毛囊数量更多。此外,III型胶原的阳性信号多于其他组,这与瘢痕组织减少和皮肤柔软度增加有关(图6g、h)。
图6 CurCoa-ApoEV-GMA支架对普通全层皮肤缺损愈合的调节作用
对于感染全层皮肤缺损,早期CurCoa-ApoEV-GMA支架组的伤口表面仅观察到少量脓性液体,并显示出明显的伤口愈合加速(图7a-c)。组织学染色结果显示,CurCoa-ApoEV-GMA组的伤口大小和炎性细胞浸润程度最小,在第6天时具有高度规则的胶原纤维结构,几乎与正常皮肤组织相同,再上皮化速率和血管数量高于其他组(图7d-f)。
图7 CurCoa-ApoEV-GMA支架对感染全层皮肤缺损愈合的调节作用
为了探究CurCoa-ApoEV-GMA在感染性全层皮肤伤口中促进愈合的分子机制,本研究收集了伤口组织样本,并使用RNA测序进行了分析。结果显示CurCoa-ApoEV-GMA组的转录特征与空白组的基因表达有明显区别,包括127个下调基因和87个上调基因(图8a、b)。GO和KEGG富集分析显示,CurCoa-ApoEV-GMA主要上调了与细胞增殖、分化和趋化因子产生调控相关的基因。上调基因富集于增殖和迁移途径,如趋化因子信号通路、JAK-STAT信号通路、PI3K-Akt信号通路以及细胞因子-细胞因子受体相互作用。GO富集分析还显示,CurCoa-ApoEV-GMA下调了与炎症和免疫反应相关的基因(图8c、d)。
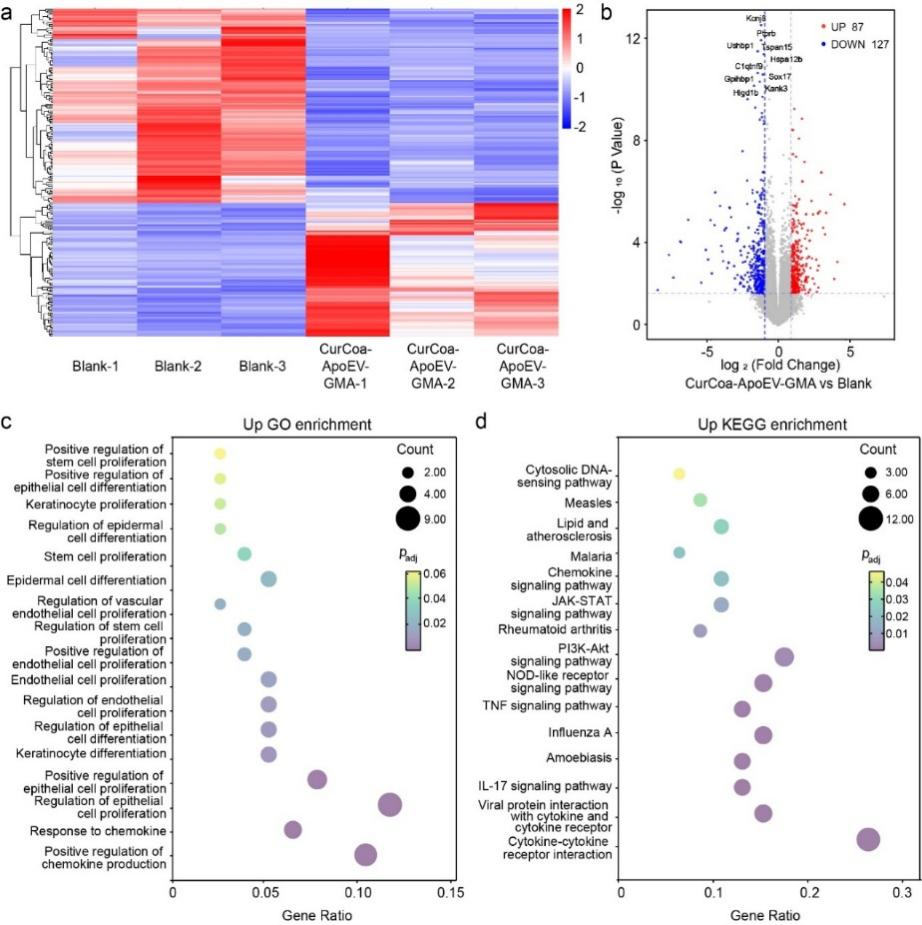
图8 CurCoa-ApoEV-GMA支架对感染全层皮肤缺损愈合过程中基因表达的影响
该多功能双层支架成为治疗皮肤缺陷的有前景的候选者,为设计应用于再生医学的皮肤支架提供了实验依据。
参考文献:
3D-printed multifunctional bilayer scaffold with sustained release of apoptotic extracellular vesicles and antibacterial coacervates for enhanced wound healing, Biomaterials. 2025 Feb 15:318:123196. doi: 10.1016/j.biomaterials.2025.123196.
外泌体资讯网 Biomaterials|四川大学刘磊/周加境/李蕙/刘晓静:脂肪组织来源凋亡囊泡联合凝聚体,促进感染创面高效愈合