外泌体作为极具潜力的液体活检生物标志物,在癌症早期检测与筛查领域前景广阔。然而,从生物样本中分离外泌体困难重重,尤其是血液样本,其成分极为复杂,大量纳米级污染物及高丰度蛋白的存在,严重阻碍了外泌体的快速高效分离和下游应用。所以,从血液样本中快速有效的分离外泌体成为推动其临床应用的关键所在。虽然超速离心法是当前外泌体分离的“金标准”,但该技术仍存在操作步骤繁琐、处理时间长、设备成本高昂以及分离到的外泌体纯度和产率低等挑战。
为应对上述挑战,华中科技大学刘笔锋教授课题组近期在ACS Nano上发表了题为“Fully Integrated Centrifugal Microfluidics for Rapid Exosome Isolation, Glycan Analysis, and Point-of-Care Diagnosis”的研究论文。华中科技大学生命科学与技术学院赵旭东博士、刘翔博士和陈途灿博士为共同第一作者,生命科学与技术学院刘笔锋教授、陈鹏副教授和同济医学院附属同济医院李秋柏教授为论文通讯作者。
该研究首次提出一种创新的全集成离心微流控芯片—iExoDisc,结合自动化离心平台,实现了从全血样本中自动分离外泌体。具体来说,iExoDisc集成了血浆分离、血浆中高丰度蛋白去除和外泌体分离等多个关键模块,仅需45分钟就能从400 μL血液样本中自动分离到外泌体,且外泌体纯度和产率显著高于传统分离方法。
在此基础上,运用iExoDisc从三阴性乳腺癌(TNBC)患者和健康对照者的血液样本中分离外泌体,并通过MALDI-TOF-MS和凝集素微阵列技术,分别进行了非靶向和靶向聚糖谱分析。结果发现,TNBC患者血浆外泌体的半乳糖基化和唾液酸化水平呈现出显著升高,表明这些聚糖变化有望成为TNBC的诊断指标,为癌症的早期诊断提供了新的方向和思路。
最后,还构建了芯片上外泌体分离和原位检测平台,在2小时内实现了从血浆样本中分离和原位检测外泌体,且检测效果良好,在区分癌症患者和健康人方面具有一定的准确性,为临床诊断提供了一种快速、有效的检测手段。
总体而言,该研究开发的的iExoDisc平台为外泌体分离以及基于外泌体的液体活检带来了新的有力工具,在临床诊断、疾病监测等领域展现出了广泛的应用潜力。
图1. iExoDisc用于全血样本外泌体的分离和下游分析示意图
(A)通过超离心从全血样本中分离外泌体。(B)通过iExoDisc从全血样本中分离外泌体。(C)通过MALDI-TOF-MS和凝集素微阵列技术分析血浆外泌体聚糖谱的示意图。(D)片上外泌体分离和原位检测示意图。
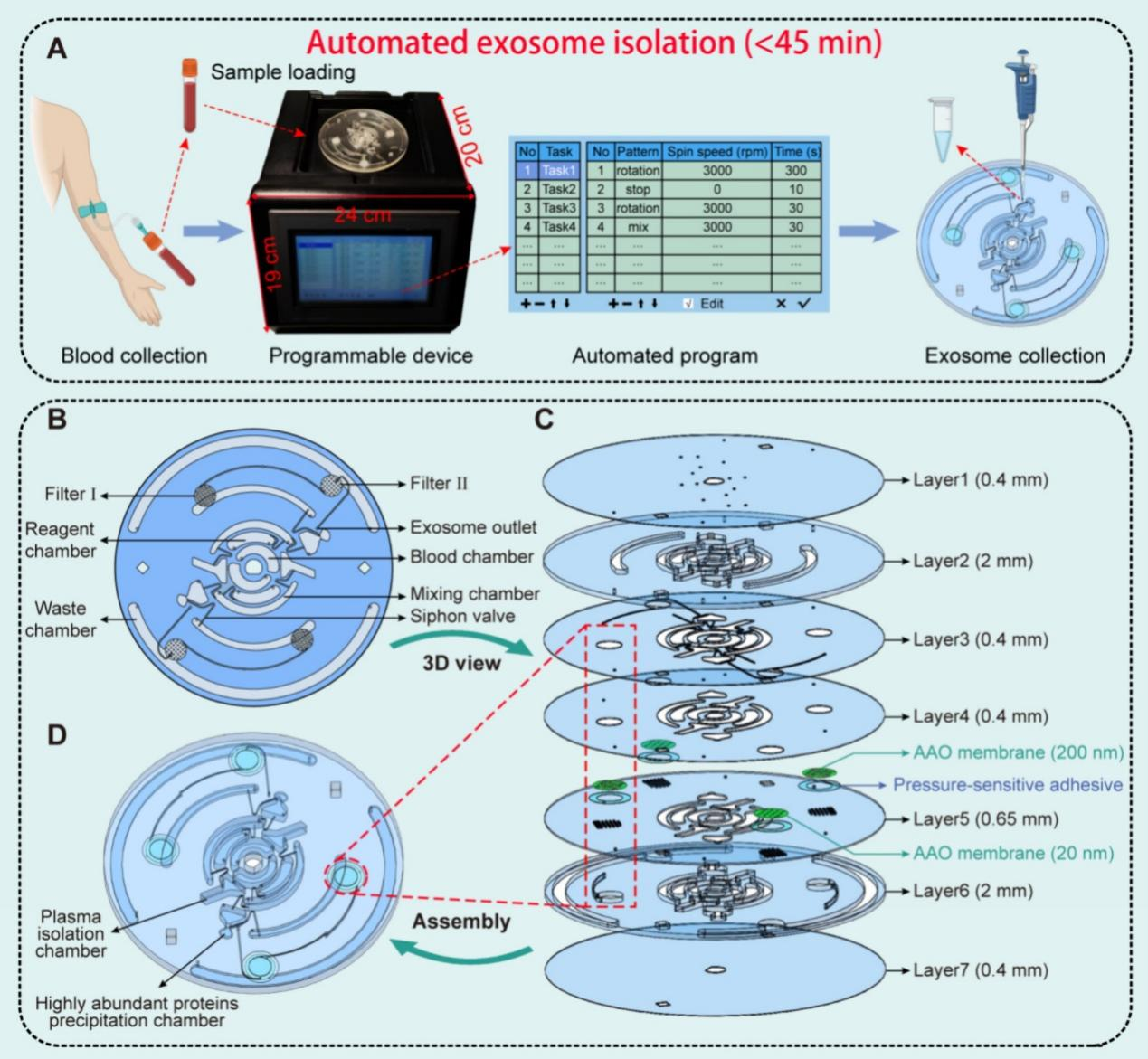
图2. iExoDisc的示意图
(A)使用iExoDisc和可编程设备从全血中自动分离外泌体的示意图。(B) iExoDisc的平面结构图。(C) iExoDisc的三维分解图。(D) iExoDisc组装的3D视图。
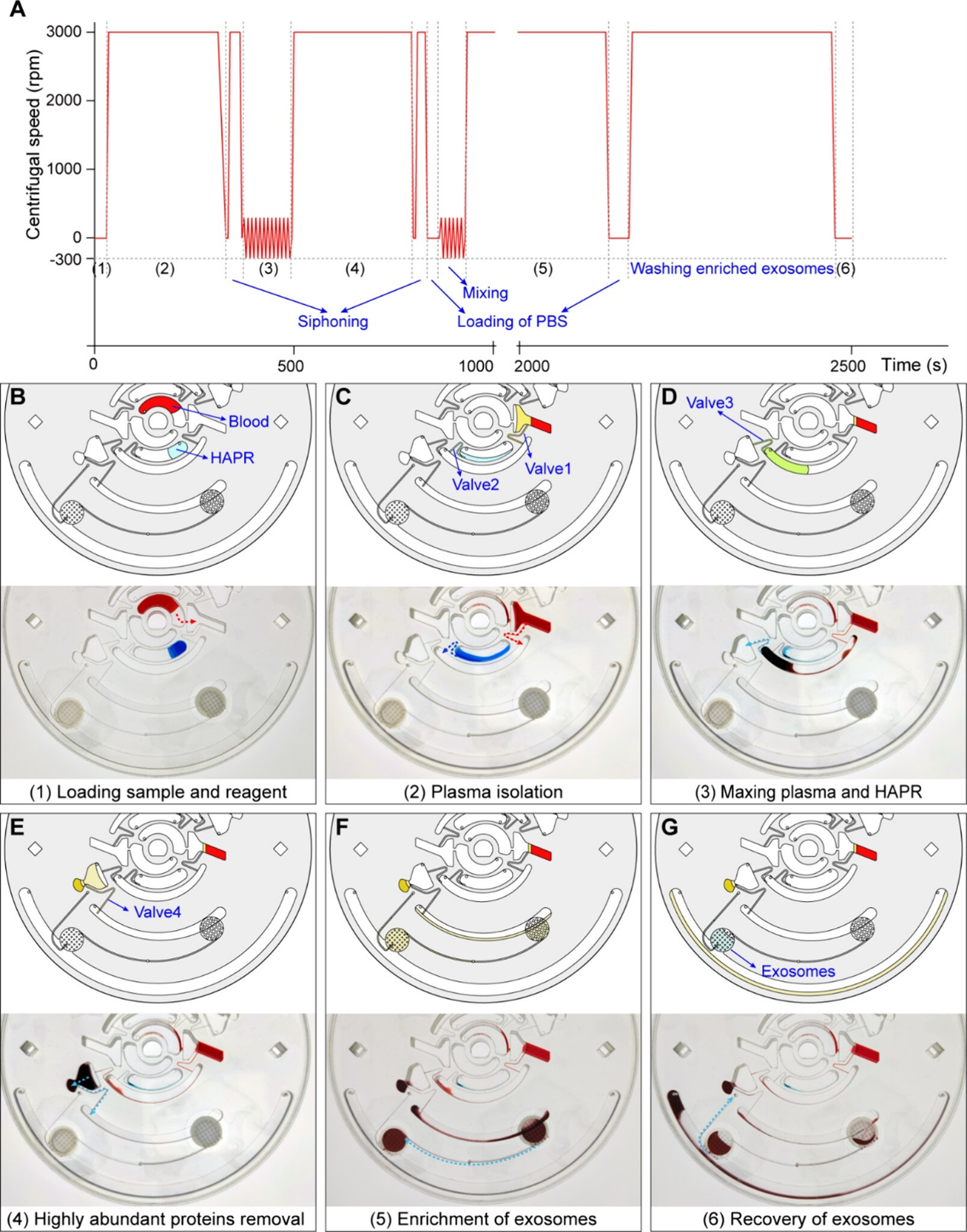
图3. 色素模拟的使用iExoDisc从全血中分离外泌体的整个过程示意图
(A)芯片在不同时段的工作控制。(B)全血和HAPR加载。(C)全血中血浆的分离。(D)血浆与HAPR的混合。(E)离心沉淀高丰度蛋白。(F)外泌体富集。(G)外泌体的清洗和收集。虚线箭头表示流体流动的方向。

图4. 片上外泌体分离和原位检测
(A)片上外泌体分离和原位检测示意图。(B)原位外泌体检测的具体过程和原理。(C)片上外泌体检测的高通量结构示意图。(D)片上外泌体检测自动化结构示意图。(E)使用从血浆中分离的不同浓度的外泌体进行原位检测。(F)热图显示乳腺癌患者(BC)和健康对照组(HC)血浆外泌体CD63的表达水平,通过芯片上外泌体分离和原位检测测量。(G) BC患者和HC血浆外泌体CD63表达水平的统计分析。(H) BC组和HC组外泌体CD63的ROC分析。
论文链接:https://www.doi.org/10.1021/acsnano.4c16988