通过病毒载体(如腺相关病毒AAV)和脂质纳米颗粒(LNP)递送VEGF-A的基因治疗临床试验结果不尽如人意,亟需开发替代递送策略。深圳湾实验室/粤港澳大湾区国际临床试验中心及北京大学深圳研究生院的Andrew Lee博士,斯坦福大学医学院的Patricia K. Nguyen 博士,中国医学学院阜外医院的兰峰博士和苏州大学附属第一医院及心血管科学研究所的沈振亚教授合作在European Heart Journal杂志上发表文章,报道了负载VEGF-A mRNA的细胞外囊泡(EVs)在治疗缺血性血管疾病中的临床前疗效和安全性。
缺血性血管疾病(IVD)——包括心肌梗死(MI)、中风和外周血管疾病——是全球发病率和死亡率的主要原因,但当前促进其血管再生的选择非常有限。在过去的二十年中,研究人员评估了血管生成基因疗法的潜力,尤其是血管内皮生长因子A(VEGF-A),以刺激新血管的生长来挽救缺血组织。过去关于VEGF血管生成疗法的随机对照试验,包括直接注射重组VEGF-A蛋白(如VIVA试验)、通过心肌注射VEGF-A质粒操纵其基因表达(如Euro inject One、VIF-CAD和NORTHERN试验)、嵌入病毒载体的VEGF-A DNA(如KAT、REVASC试验)以及裸合成mRNA(如EPICCURE试验),在治疗缺血性肢体或心脏组织的患者中显示出有限的疗效。导致临床试验疗效不佳的障碍包括注射的重组VEGF-A蛋白的不稳定性、质粒DNA的转染效率低下、载体(如腺相关病毒,AAV)的免疫原性以及药代动力学的延迟。克服这些递送挑战的一个近期策略是开发脂质纳米颗粒(LNP)包裹的治疗性mRNA,这一策略在mRNA COVID-19疫苗的快速临床转化中得到了证明。然而,有报告指出,与携带mRNA疫苗的LNP相关的注射部位局部炎症(如“COVID手臂”)、全身性过敏反应以及器官特异性延迟性过敏反应(如心肌炎),表明这些合成载体中的核心成分(如合成聚合物、不可降解的无机材料和聚乙二醇)具有免疫原性,这为其在非疫苗临床应用中的疗效提出了新的挑战,并引发了安全性担忧。作为体内转运生物分子和核酸的天然载体,细胞外囊泡(EVs),包括外泌体和微囊泡,已经成为一种有前景的非病毒替代递送系统,用于将基因疗法输送到靶组织。该研究展示了细胞纳米孔化(CNP)技术能够大规模将全长VEGF-A mRNA加载到分泌的EV中,从而实现临床转化的高效制造和储存。将加载VEGF-A mRNA的EV(VEGF-A EVs)递送到小鼠缺血性肢体和心肌模型中,在靶部位产生了快速、短暂和脉冲式的VEGF-A表达,与接受盐水治疗的对照组和接受AAV与LNP VEGF-A基因疗法治疗的动物相比,功能恢复显著改善。重要的是,与AAV和LNP对照组不同,多次体内注射VEGF-A EVs未观察到刺激、过敏反应或其他免疫激活,从而证明了EV mRNA递送在克服与当前基因疗法临床方式(如通过病毒载体或LNP包裹递送的DNA/mRNA)相关的免疫原性障碍方面的潜力。总体而言,本研究表明,加载VEGF-A的EV可能为向缺血组织递送血管生成基因疗法提供一种有效且潜在更安全的途径。
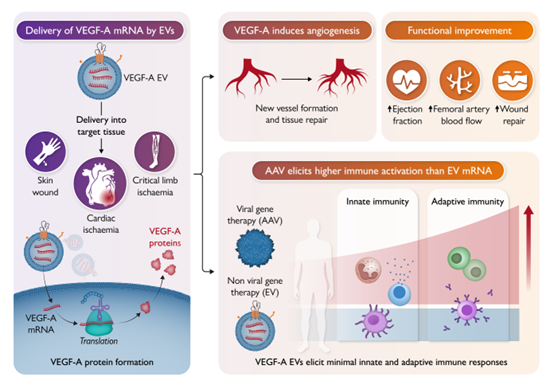
通过细胞纳米孔化技术将全长VEGF-A mRNA封装进细胞外囊泡(VEGF-A EVs)后,VEGF-A EVs被注射递送至目标组织(例如,用于治疗心肌缺血的心肌组织、用于治疗慢性肢体缺血的骨骼肌,以及用于治疗皮肤伤口的皮肤组织)。VEGF-A EVs刺激了血管生成并改善了组织愈合,从而实现了功能恢复(例如,在小鼠心肌梗死模型中改善射血分数,在小鼠外周血管疾病模型中改善股动脉血流,以及在皮肤损伤模型中促进伤口愈合)。重要的是,与通过腺相关病毒(AAVs)递送的VEGF-A疗法不同,VEGF-A EVs未激活先天或适应性免疫系统。注:EVs,细胞外囊泡;VEGF-A,血管内皮生长因子A;AAV,腺相关病毒。准备和体外递送VEGF-A细胞外囊泡(EVs)为了生成负载VEGF-A mRNA的EVs,该研究通过纳米转染技术(CNP)将VEGF-A-GFP融合质粒导入新生人类真皮成纤维细胞(nHDFs),从而生产出nHDF来源的、包裹全长VEGF-A mRNA的EVs。通过纳米颗粒追踪分析(NTA)表明,CNP生成的VEGF-A EVs在结构上与未处理细胞培养基中收集的对照EVs具有一致性,尺寸分布峰值约为150 nm。电位和原子力显微镜检测显示VEGF-A EVs与对照EVs在电荷密度和膜特性方面无显著差异。然而,VEGF-A EVs组显示更高的外泌体相关(如CD9、CD63和TSG101)和微囊泡相关(ARF6)标志物的表达,证明CNP处理后nHDF供体细胞分泌了更多的EVs。此外,RT-qPCR显示,CNP分泌的EVs中VEGF-A mRNA含量超过未转染细胞分泌的EVs的3000倍。通过凝胶电泳进一步验证了这些EVs中封装了大量全长转录的VEGF-A mRNA,并无DNA模板污染。单个EV中包裹VEGF-A mRNA的情况通过全内反射荧光显微镜分析得以证实。在体外实验中,VEGF-A EVs成功地被诱导多能干细胞来源心肌细胞(iPSC-CMs)内化。通过免疫荧光显微镜和荧光强度分析,我们确认VEGF-A蛋白在受体细胞中显著表达。此外,Western blot进一步验证了mRNA的成功递送和蛋白质的翻译。这些结果表明,CNP生成的VEGF-A EVs可以有效递送VEGF-A mRNA至受体细胞并实现高效蛋白表达。VEGF-A EVs在体内的mRNA表达和蛋白翻译为了评估VEGF-A EVs递送mRNA并在体内形成蛋白的动力学,将标记有GFP的VEGF-A EVs注射到免疫健全小鼠的胫前肌(TA)中。在递送后12小时,RNAscope结果显示VEGF-A mRNA表达显著增加,48小时后逐渐下降,7天后恢复到基线水平。免疫荧光染色、Western blot和酶联免疫吸附试验(ELISA)显示VEGF-A蛋白表达在处理后48小时显著增加,并持续到7天。类似的实验在小鼠心肌梗死(MI)模型中重复,证实了VEGF-A mRNA和蛋白在梗死边缘和受损区域的释放。此外,通过CD31阳性细胞(内皮细胞标志物)免疫荧光染色,发现VEGF-A EVs处理组在小鼠胫前肌中显示更高的新血管生成水平。这些数据支持VEGF-A EVs递送可在体内增加VEGF-A蛋白生成并刺激受体组织中血管新生。VEGF-A EVs在缺血性损伤模型中的治疗效果为了进一步评估VEGF-A EVs的治疗效果,利用CNP技术在小鼠NIH/3T3细胞中生成小鼠VEGF-A EVs(mVEGF-A EVs)。在心肌梗死模型中,mVEGF-A EVs注射到梗死区域附近,与对照组相比,治疗组在左心室功能和缩短分数等方面表现出显著改善,并通过心脏磁共振成像得到验证。此外,组织学分析显示mVEGF-A EVs治疗组纤维化组织减少,心肌壁厚度得到更好的保护。通过番茄凝集素染色和CD31染色确认,mVEGF-A EVs递送显著提高了毛细血管和小动脉密度。在缺血性肢体模型中,hVEGF-A EVs的递送显著改善了缺血肢体的血流灌注,并增加了CD31阳性细胞和新生血管密度。这些结果表明,VEGF-A EVs在心脏和肢体缺血性损伤模型中具有良好的再血管化能力。VEGF-A EVs的免疫原性评估和重复递送潜力与传统VEGF基因疗法因递送载体引起的免疫原性问题不同,mVEGF-A EVs表现出最低的免疫激活水平。与mVEGF-A LNPs和mVEGF-A AAVs相比,mVEGF-A EVs在小鼠肌肉中几乎未引起巨噬细胞和中性粒细胞浸润。ELISpot分析显示,只在AAV和LNP组中观察到显著的IFN-γ阳性T细胞响应,而mVEGF-A EVs组则未见明显的适应性免疫激活。此外,与AAV和LNP相比,mVEGF-A EVs在体内递送未引起显著的细胞因子分泌或抗体生成。为测试重复注射的潜力,该研究在小鼠皮肤创伤模型中进行了五次连续注射实验。结果表明,与AAV和LNP治疗组相比,mVEGF-A EVs组显示更快的伤口愈合速度、更少的炎症反应以及更好的血管新生效果。这进一步说明mVEGF-A EVs可用于多次递送,而不会触发显著的免疫反应。总结本研究通过CNP技术成功生产并验证了VEGF-A EVs在体内外的高效递送和治疗效果。与传统载体(如LNP和AAV)相比,VEGF-A EVs表现出低免疫原性和高治疗潜力,尤其是在促进缺血性组织再血管化方面。此外,其低免疫激活特性支持其作为一种安全且有效的基因治疗递送平台,尤其适用于需要重复注射的治疗场景。未来的研究可进一步优化VEGF-A EVs的制备和递送策略,以扩大其在临床中的应用范围。临床转化意义这是首个直接比较通过腺相关病毒(AAV)载体、脂质纳米颗粒(LNPs)和细胞外囊泡(EVs)递送基因疗法的疗效和安全性的研究。研究进行了正面对比,评估了通过EVs、LNPs和AAV载体递送VEGF mRNA基因疗法在缺血性肢体肌肉和心脏组织中促进血管再生的效果。结果显示,与通过LNPs或AAV载体递送的VEGF基因疗法相比,负载VEGF-A mRNA的细胞外囊泡在改善缺血小鼠模型下肢灌注和心脏功能方面更为有效。重要的是,本研究表明,EVs的更高免疫耐受性可能是其更高疗效的原因之一,这暗示EVs在低免疫原性核酸递送方面可能具有比之前认识到的更广泛的临床应用潜力。本研究为继续开发VEGF-A EVs并向首次人体临床试验推进奠定了基础。
参考文献:
You Y, Tian Y, Guo R, Shi J, Kwak KJ, Tong Y, Estania AP, Hsu WH, Liu Y, Hu S, Cao J, Yang L, Bai R, Huang P, Lee LJ, Jiang W, Kim BYS, Ma S, Liu X, Shen Z, Lan F, Phuong Nguyen PK, Lee AS. Extracellular vesicle-mediated VEGF-A mRNA delivery rescues ischaemic injury with low immunogenicity. Eur Heart J. 2025 Jan 20:ehae883. doi: 10.1093/eurheartj/ehae883. PMID: 39831819.
外泌体资讯网 【Eur Heart J】细胞外囊泡递送VEGF-A mRNA挽救缺血性损伤且免疫原性低,优于AAV和LNP





