近年来,细胞外囊泡(Extracellular Vesicles, EVs)因其独特的生物学特性,成为神经退行性疾病研究领域的热点。作为由细胞分泌的脂质包裹纳米颗粒,EVs能够递送蛋白质、核酸和代谢物等多种生物分子,不仅在维持中枢神经系统正常功能中发挥重要作用,同时也通过携带β-淀粉样蛋白、Tau蛋白和α-突触核蛋白等病理因子,介导阿尔茨海默病、帕金森病等疾病的跨细胞传播,成为推动病情进展的重要“帮凶”。更令人瞩目的是,因其具备穿越血脑屏障的能力,通过血液等外周体液检测CNS来源的EVs已为无创诊断提供了前所未有的可能。2025年3月,浙江大学医学院第一附属医院章京教授团队在eBioMedicine杂志发表了题为“Extracellular vesicles: new horizons in neurodegeneration”的综述文章(2025 Mar:113:105605.)。该研究系统概括总结了EVs的分离与表征技术、EVs穿越血脑屏障的机制及其作为诊断标志物和治疗工具在神经退行性疾病中的关键作用。第一作者是浙江大学博士生陈珺和浙江大学医学院第一附属医院主治医师田辰,通讯作者为浙江大学医学院第一附属医院章京教授和杨迎研究员。
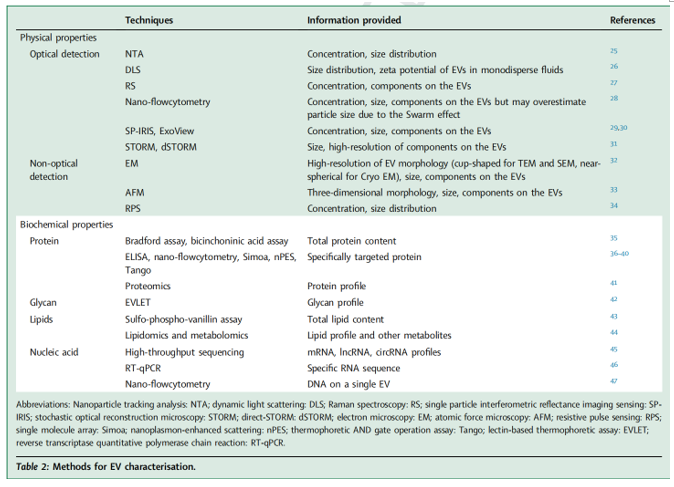
传统的外泌体分离方法主要包括超速离心、超滤、沉淀、尺寸排阻色谱(SEC)以及基于微流控技术的分离技术,各自依靠密度、分子大小、聚集特性和物理结构等不同原理实现分离。传统方法虽各有应用,但存在如脂蛋白污染、化学残留等局限性;为此,研究者通过多种优化策略提升分离效果,例如,利用TiO₂辅助超滤提高产率与纯度、在PEG沉淀后加入超速离心步骤去除化学残留,以及通过优化横向流场分离参数减少脂蛋白干扰并保持外泌体完整性。研究介绍了新型EXODUS系统,其利用负压振荡和双耦合谐振器产生的双频横向波,实现了超快速、高产量且高纯度的外泌体分离。此外,研究梳理了一系列EVs表征技术(表1)。传统地表征技术常用NTA、DLS、流式细胞术、电子显微镜等手段分析EVs的大小、浓度与形态;用ELISA、BCA法等分析其蛋白表达。最新的超敏Simoa平台、Tango热迁移平台、EVLET糖基检测系统[1]等新方法,能够在极小样本量中实现对EVs蛋白、核酸、糖类等多维度成分的高灵敏检测,极大地拓展了EVs在疾病诊断与生物标志物开发中的应用潜力。
EVs能够跨越血脑屏障实现中枢神经系统(CNS)与外周之间的双向交流,主要依赖多种转胞吞途径,包括网格蛋白介导内吞、caveolae介导内吞、吸附介导转胞吞和微胞饮作用。具体研究表明,神经干细胞来源EVs通过硫酸乙酰肝素蛋白聚糖与内皮细胞黏附,启动网格蛋白介导的跨膜运输,而胶质瘤细胞来源EVs富集cavin1蛋白,增强了caveolae形成与转运效率。此外,为了研究CNS来源EVs的外周输送路径,多项工具被开发应用,包括表达CD63-GFP的小鼠和大鼠模型,实现神经干细胞特异性EVs的体内追踪[2],以及NoMi系统,通过双标记的CD63纳米荧光素和mCherry实现多细胞来源EVs的可视化检测[3]。这些技术手段不仅揭示了EVs在生理与病理条件下跨越血脑屏障的动态过程,也为后续探索CNS疾病标志物开发与EVs载药系统提供了坚实的技术平台和理论依据。
大量研究证实,CNS来源EVs在多种神经退行性疾病的发生与进展中发挥着核心作用。AD患者脑组织中的EVs富含Aβ寡聚体,能够在神经元间传播并诱导细胞死亡;小胶质细胞释放的含Tau EVs也被证实促进了Tau蛋白的扩散,并可通过抑制P2X7R显著减少病理传播。类似地,α-synuclein通过EVs介导的细胞间转移推动PD病程。此外,ALS、FTD等疾病相关的TDP-43、SOD1以及HD患者来源的扩展CAG重复mRNA和mtDNA,均被发现存在于CNS来源EVs中,提示EVs在蛋白质和核酸异常积累中的“播散者”角色。除蛋白与RNA外,EVs代谢物如富含神经炎症相关神经酰胺的星形胶质细胞EVs,也被证实会加剧神经元凋亡和氧化应激,形成炎症正反馈。在临床应用上,血浆中CNS来源EVs作为无创生物标志物展现出巨大潜力(图1)。研究发现,神经元来源的L1CAM+、ATP1A3+ EVs中Aβ42、pTau181及α-synuclein水平可分别用于区分AD、PD患者并监测认知功能。GLT-1+星形胶质细胞EVs中α-synuclein的检测有助于区分PD与MSA[4];而少突胶质细胞来源CNPase+、MOG+ EVs中α-synuclein水平的变化则为MSA诊断提供依据。对于小胶质细胞,CX3CR1+UCHL1+ EVs标志物结合策略有效提升其在血浆中的识别特异性。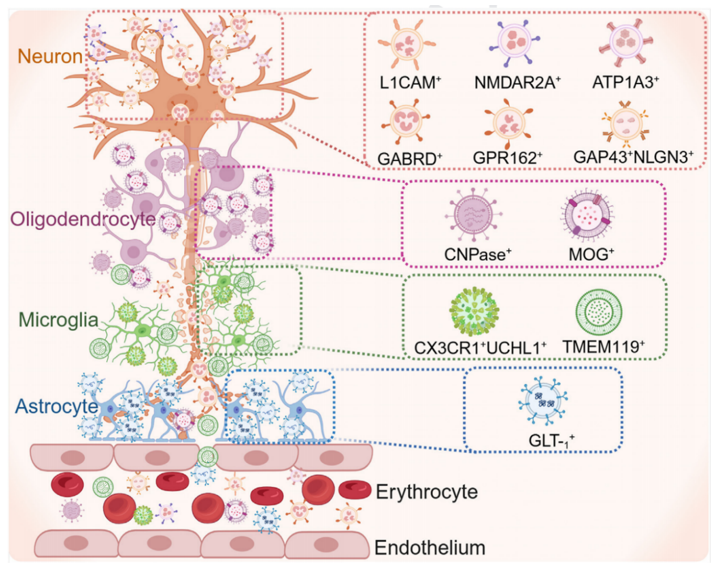
图2.EVs作为诊断标志物
治疗应用方面,EVs凭借天然的靶向性和生物相容性,成为突破血脑屏障的药物递送载体。各种干细胞来源的EVs在动物模型中显著抑制神经炎症、减少病理蛋白沉积,并促进突触再生。尽管这些外泌体显示了潜在的神经保护作用,但由于其复杂的货物组成,仍可能带来不可预测的效果。将治疗性分子如miRNA加载到外泌体中有望提高其疗效,且CRISPR-Cas9基因编辑技术结合外泌体治疗,可能为治疗遗传性神经退行性疾病提供更加有效和可持续的解决方案。工程化修饰的EVs(如狂犬病毒糖蛋白或转铁蛋白修饰)进一步提升了脑部靶向效率,为个性化治疗奠定基础。尽管前景广阔,EVs的临床应用仍面临挑战。EVs的高度异质性、规模化生产的标准化难题,以及免疫原性的不确定性,亟待跨学科合作解决。未来,通过多组学技术解析EVs的分子特征、开发多重标记检测体系,将推动诊疗手段的革新。随着技术的迭代,EVs或将成为神经退行性疾病从实验室到临床转化的关键桥梁,为全球数亿患者带来曙光。Extracellular vesicles: new horizons in neurodegeneration, EBioMedicine. 2025 Mar:113:105605. doi: 10.1016/j.ebiom.2025.105605.外泌体资讯网 eBioMedicine | 细胞外囊泡:神经退行性疾病诊疗的新视野