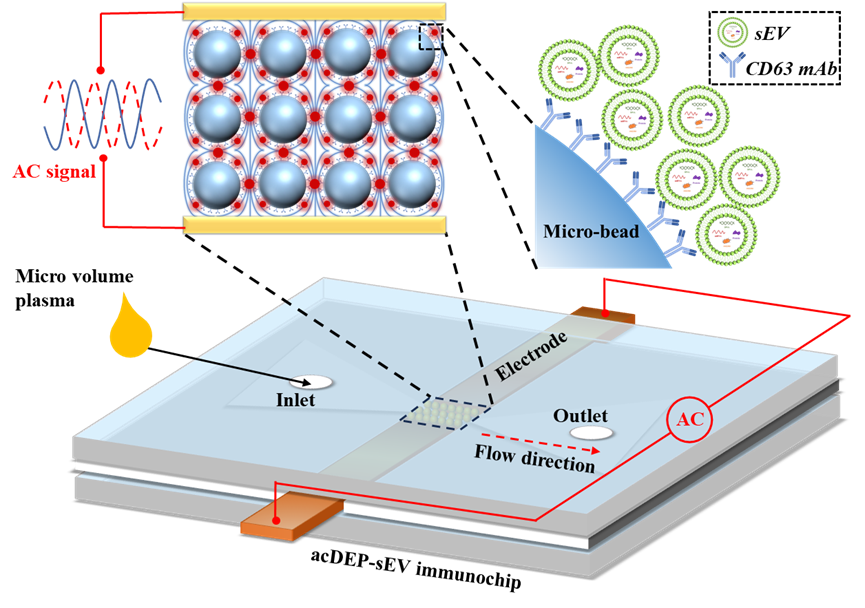
小细胞外囊泡(sEVs)内含来自原始细胞的核酸和蛋白质等生物标志物,是液体活检的理想标志物。由于sEVs体积微小且密度接近体液,在复杂生物样品中对其进行快速分离和检测仍存在挑战。微流控技术以其小型化、集成化、高通量、低样品需求和低试剂消耗等优势,为sEVs的分离和检测提供了新的手段。
目前,基于免疫亲和力的方法是微流控液体活检设备分离和检测sEVs的主要策略,通常在各种复杂微通道表面固定抗体来捕获sEVs。但由于抗体与sEVs表面蛋白的结合依赖于被动扩散,而微通道内普遍存在层流现象,导致传质效率较低,从而影响了检测的灵敏度和效率。
近期,吉林大学杨方教授和李桂英教授在Analytical Chemistry上发表题为“Small Extracellular Vesicles Detection by Dielectrophoresis-Based Microfluidic Chip Filled with Transparent Antibody-Conjugated Microbeads for Breast Cancer Diagnosis“的论文(2025, 18;97(10):5678-5687),主要介绍了一种将介电泳和免疫亲和相结合的acDEP-sEV免疫芯片,通过在芯片反应腔中填充抗体偶联微珠,构建非均匀电场,扰乱层流提高传质效率,聚焦荧光信号,最终实现快速灵敏、可调的sEVs捕获和检测。该方法仅需20−50 μL血浆样本,在不到35分钟内即可完成液体活检,检测限(LOD)为54 sEV/μL。文章共同第一作者为吉林大学硕士研究生兰梅、吴迪,通讯作者吉林大学杨方教授和李桂英教授。
研究思路与内容
1、芯片设计与制备
研究人员设计并制作了acDEP-sEV免疫芯片(图1)。在芯片的反应腔中填充透明抗体偶联微珠,使微珠单层充满反应腔,迫使液体只能从它们之间的缝隙流过。这种设计能够有效的扰乱层流,提高外泌体的捕获效率,并聚焦荧光信号,提高检测灵敏度。同时,在p-DEP力的作用下,sEVs主动向抗体偶联微珠表面移动,而不是单纯依靠被动扩散。这种主动运动不受流体传质边界效应的影响,使得固定在微珠上的抗体能够捕获更多的sEVs,显著提高了免疫捕获效率,从而有效地提高了sEVs的检测效率和灵敏度。
图1 acDEP-sEV免疫芯片示意图
2、功能验证
通过扫描电子显微镜(SEM)表征了抗体偶联微珠的成功制备。使用PKH67染色试剂盒提取的sEVs验证了acDEP-sEV免疫芯片捕获和检测sEVs的能力,结果显示芯片能够有效捕获sEVs。进一步使用MCF-7细胞培养上清液中的sEVs进行检测,与对照组(DMEM培养基)相比,检测组显示出更强的荧光信号,证明芯片能够在复杂样本中检测sEVs。
3、影响因素分析
该研究研究了频率、电压、样本体积和流速对sEVs捕获的影响。结果表明,在500 kHz、10 Vp-p的电场条件下,芯片对sEVs的捕获效果最佳。而且研究发现即使不使用注射泵,使用微量移液器将样本注入芯片反应室,芯片也能够有效捕获和检测sEVs。
4、性能评估
芯片在sEVs检测中表现出良好的重复性、稳定性和特异性。抗体偶联微珠在−20 °C下储存12周后仍保持良好稳定性。芯片能够特异性检测不同细胞系分泌的sEVs,如检测人胚胎肾细胞(HEK-293T)和两种乳腺癌细胞系(MCF-7和MDA-MB-231)培养上清液中的总sEVs和EpCAM阳性sEVs,结果显示癌细胞分泌的sEVs中EpCAM的含量显著高于健康细胞。、
5、检测限研究
通过校准荧光强度与sEVs浓度,得出acDEP-sEV免疫芯片的检测限为54 sEV/μL,显著提高了sEVs检测的灵敏度。
6、临床样本分析
研究通过检测10名乳腺癌患者和10名健康志愿者的血浆样本(图2),发现乳腺癌患者血浆中总sEVs、EpCAM阳性和MUC1阳性sEVs水平显著高于健康志愿者。而且发现多标志物联合评估具有极高的灵敏度、准确性和特异性。
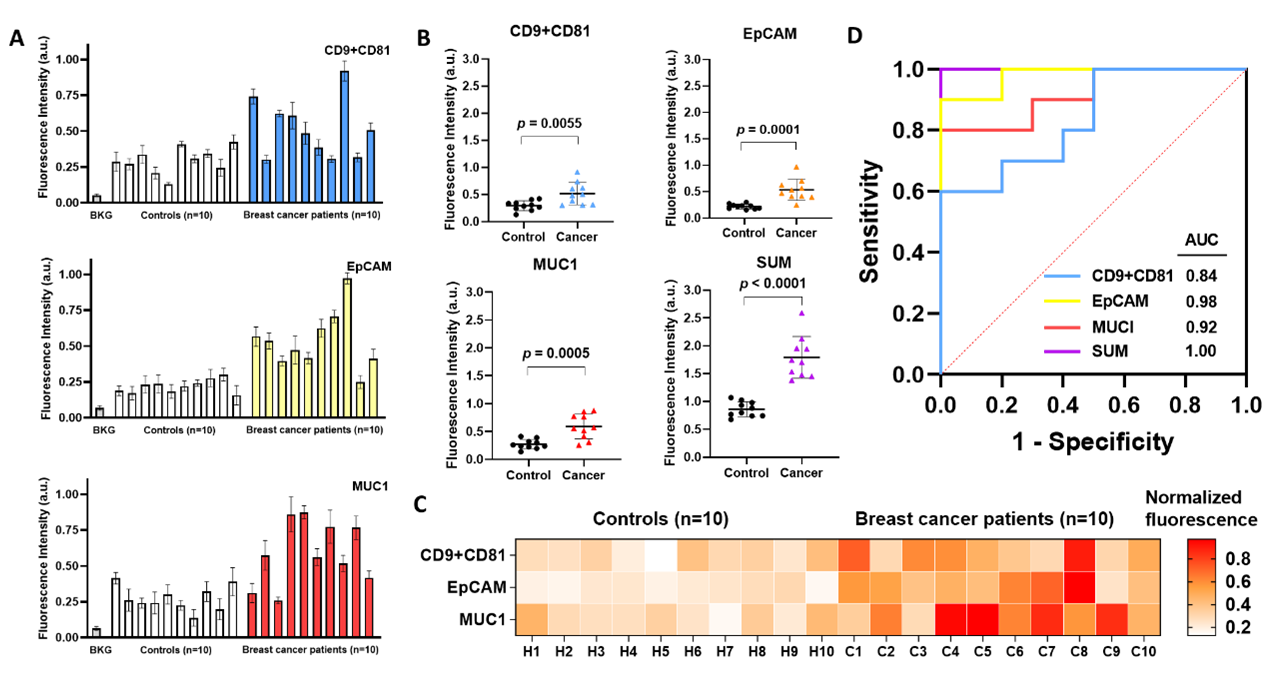
图2 用于乳腺癌诊断的sEV生物标志物临床分析
结论:
该研究开发的acDEP-sEV免疫芯片结合了DEP和免疫亲和方法,能够快速、灵敏地检测sEVs。芯片具有良好的重复性、稳定性和特异性,检测限低至54 sEV/μL。在乳腺癌诊断中,多标志物联合评估显著提高了基于sEVs的诊断灵敏度和准确性。总之,该研究开发的基于DEP和免疫亲和相结合的sEVs液体活检装置,为sEVs在疾病诊断、治疗和预防中的研究和应用提供了一种新的方法和策略。
参考文献:
Lan, M. et al. Small Extracellular Vesicles Detection by Dielectrophoresis-Based Microfluidic Chip Filled with Transparent Antibody-Conjugated Microbeads for Breast Cancer Diagnosis. Analytical Chemistry 97, 5678-5687 (2025). https://doi.org/10.1021/acs.analchem.4c06592
外泌体资讯网 Anal. Chem|吉林大学杨方教授、李桂英教授:填充透明抗体偶联微珠的介电泳微流控芯片检测小细胞外囊泡用于乳腺癌诊断