近年来,细胞外囊泡(EVs)作为天然药物递送载体在纳米医学领域展现出巨大潜力,然而其临床应用的最优细胞来源尚不明确,已成为制约EVs临床转化的关键挑战之一。HEK293F 细胞因其适应高密度悬浮培养、可在无血清化学成分限定的培养基中生长、EV 产量高且易于遗传修饰等优势,被认为是开发 EV 递药系统的“明星细胞”候选者。然而,HEK293F-EVs 在生产过程中的稳定性及长期给药安全性等关键问题仍缺乏系统性研究,严重阻碍了其临床应用的推进。
近日,东南大学附属中大医院肾脏内科刘必成教授研究团队在国际知名期刊Journal of Controlled Release(《控制释放杂志》,IF=10.5)在线发表了题为 “A comprehensive evaluation of stability and safety for HEK293F-derived extracellular vesicles as promising drug delivery vehicles”的研究论文。该研究系统评估了HEK293F细胞来源细胞外囊泡(HEK293F-EVs)的稳定性与安全性,为其作为下一代药物递送载体的临床转化提供了关键科学依据。
该论文第一作者为陈志清博士、汤涛涛副研究员,通讯作者为刘必成教授、吕林莉教授和汤涛涛副研究员。该研究得到了国家自然科学基金重点项目、面上项目、青年科学基金项目以及“东南大学—科兴制药细胞外囊泡递药技术产业化联合创新实验室”共建项目等多项资助。
研究团队对HEK293F-EVs进行了全面且深入的分析,重点评估其在不同细胞代次和批次间的稳定性及体内长期安全性,并取得了重要进展。该研究发现:(1)不同细胞代次(P10、P20、P30)来源的HEK293F-EVs在理化性质(如形态、粒径分布、Zeta电位、蛋白标志物)、纯度、产量和化学组成方面均保持高度稳定,支持其具备长达30代规模化生产的潜力。(2)多组学分析进一步揭示,HEK293F-EVs的分子组成(蛋白质、miRNA、代谢物和脂质)在不同批次间高度一致,且生物信息学分析显示其成分未富集与急性免疫应答或细胞毒性相关的分子。(3)更重要的是,体内研究证实HEK293F-EVs具有优异的生物相容性和长期安全性。在小鼠中进行多次重复给药(每3天一次,共10次)后,未观察到明显的组织毒性和免疫原性,充分验证了其在体内长期递送应用中的安全性。
这项研究从稳定性和安全性两大核心维度出发,全面揭示了HEK293F-EVs在代次和批次间的优异稳定性,支持其未来大规模工业化生产的可行性。同时,其良好的生物相容性与安全性为长期重复给药提供了有力支撑,凸显了其作为药物递送载体的巨大潜力。总体而言,该研究为HEK293F-EVs作为下一代药物递送平台的临床转化奠定了坚实的理论基础,有望推动其在纳米医学治疗领域的广泛应用。
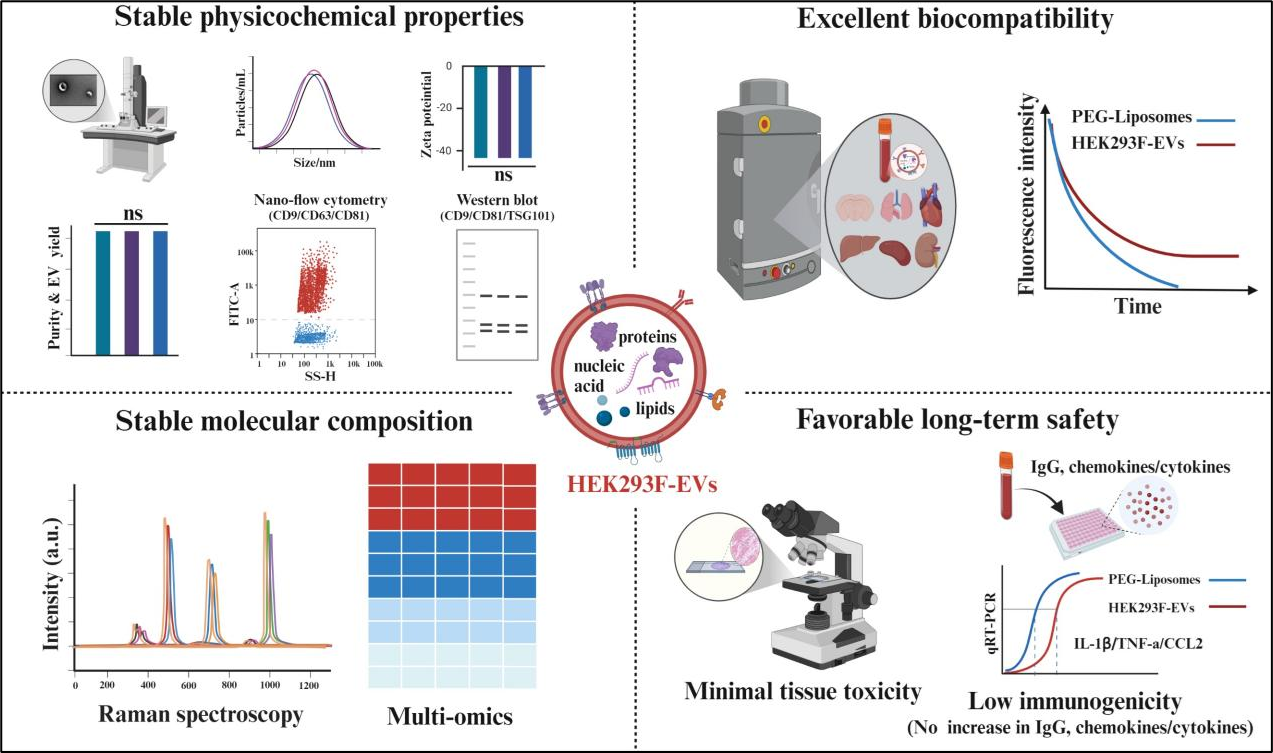
核心发现示意图
参考文献:
A comprehensive evaluation of stability and safety for HEK293F-derived extracellular vesicles as promising drug delivery vehicles, J Control Release. 2025 Mar 30:113673. doi: 10.1016/j.jconrel.2025.113673.
外泌体资讯网 J Control Release丨刘必成教授团队最新研究揭示HEK293F-EVs作为下一代药物递送平台具有稳定和安全性





