细胞外囊泡(EVs),尤其是外泌体(Exo)在血液恶性肿瘤(HM)中发挥重要作用。Exo经由多泡小体产生,是HMs中肿瘤细胞与微环境之间交流的重要手段。
然而,Exo是最小的EV种群之一,其常规定义的尺寸为10-150 nm。EV的另一个重要组是微泡(MV),150-1000 nm的颗粒,来源于细胞膜的出泡。关于HM的MV,我们具体知道些什么呢?最重要的是,Exo和MV在这些肿瘤中的作用有什么差异,还是仅仅是语义不同?
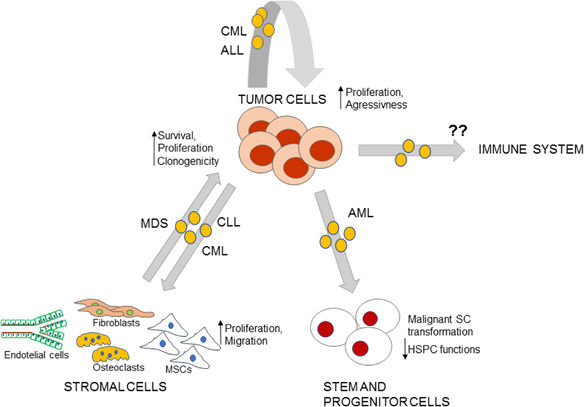
一些研究表明,在不同的条件下,肿瘤细胞,包括红细胞胚质细胞,慢性骨髓性白血病(CML)和前B型急性成淋巴细胞白血病细胞,在自分泌反馈环路中产生调节自身的MV。这与肿瘤自动维持和侵袭性增加的概念相关。
MVs介导干细胞和恶性肿瘤之间的沟通。特别是已经证明,来自白血病干细胞的MV促进急性骨髓性白血病(AML)细胞的增殖、迁移和抑制细胞凋亡。AML-MV还可以促进健康造血干细胞的生存,而不改变其未成熟表型及其形成集落的能力,但是可以诱导白血病样功能特征,如miR21和miR29过表达。
MV还介导骨髓(BM)基质和肿瘤之间的交流。例如,发现慢性淋巴细胞白血病(CLL)-MV在微环境的活化中起重要作用,有利于通过AKT信号通路的疾病进展并诱导产生VEGF,这是CLL细胞的存活因子。来自骨髓增生异常综合征(MDS)患者的间充质基质细胞(MSCs)的MV强烈修饰CD34 +干细胞性质,促进其活力、克隆能力和改变miRNA和基因表达谱。含有来自CML细胞的“白血病”转录物的MV能够在健康的MSC中转移这些mRNA,增加其增殖。来自CML的BCR/ABL-MV也诱导正常单核细胞的恶性转化,通过增加DNA甲基化有利于基因组不稳定性。研究人员在不同的设置中证明,MSC的Exo和MV都可以通过miRNA使脐带血CD34+干细胞活性更好、分化程度更低,能够改善体内小鼠模型的移植驻留率。因此,可以得出结论,MV作同Exo一样是HM中肿瘤和微环境之间的交流的重要参与者(图1)。
图 1. MV在HM的BM微环境中的作用的总结。BM细胞释放可通过自分泌或旁分泌(灰色箭头)在受体细胞上起作用的MV。恶性MV可以使肿瘤更具侵略性,其基质在支持肿瘤生长中“更强”。此外,肿瘤MV可诱导HPSC功能的抑制和SC恶性表型。MV对免疫系统的可能作用尚未证明。HPSCs, hematopoietic progenitor and stem cell; SC, stem cell.
研究表明,与健康受试者相比,具有不同HM的患者具有更高的MV水平。这些MV暴露了特定的肿瘤相关抗原,其量与一些临床参数显著相关。此外,在一大批CLL患者中发现,CD19和CD37阳性的MV总数与晚期临床分期相关,可预测总体生存,并且在初期阶段患者中也与治疗时间相关。另有研究表明血浆CD52+ MV优先从CLL细胞释放,并且它们是肿瘤进展的预测生物标志物。最后,在多发性骨髓瘤(MM)中,已经报道CD138+ MV量与临床分期和治疗反应相关,而血浆CD147+ MV在进展期间已经出现。
关于EVs的分子“货物”,大多数信息涉及Exo中的内容,而HM中的MV数据很少。
已经在白血病细胞系上清液和肿瘤患者血清的中发现了含有肿瘤融合转录物(如BCR-ABL,MLL-AF6或TEL-AML1)的MV。研究发现,MV和Exo miR155含量均显着高于 CLL、AML、Waldenstrom巨球蛋白血症EVs,与对照组相比,MDS和MM组较低;有趣的是,在AML患者中,miR155水平与白细胞计数和复杂核型这两个公认的不利预后因子呈正相关。最后,在抗CD38单克隆抗体治疗期间,MM血浆细胞产生的CD38+ MV包被治疗性IgG,确定其对表达具有不同亲和力的IgG Fc结构域的受体细胞具有更好的靶向性;MV中包含的上调基因似乎在免疫应答和凋亡过程中发挥作用。
EV领域有必要对以下几点加以澄清。首先,精确和绝对的尺寸范围还没有明确定义,从而提高不同EV类型可能重叠的可能性;这很难区分他们,如果不是差别很大的话。第二,EV纯化方法不能完全分离不同的EV种群。到目前为止,EV纯化的“黄金标准”仍然是超速离心,被80%以上的研究人员使用。其他几种方法,例如尺寸排阻色谱法、过滤法、基于聚合物的沉淀法、微流体法和亲和力捕获法等,都正在研究和尝试当中。
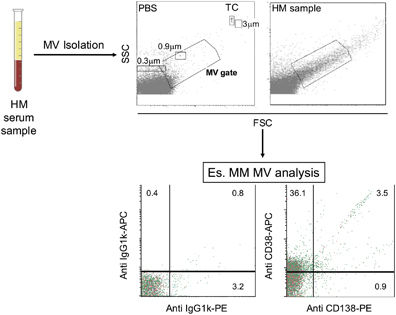
理想的生物标志物应该容易获得,对患者产生最小的不适。此外,应该准确和可重复。目前,液体活检方面的研究极具吸引力,使用EV作为真正的“细胞活检”极具可能性。从实践的角度来看,对于Exo而言,较大尺寸的MV允许疾病抗原在更大的表面上展现,从而允许它们通过细胞荧光分析方便地进行检测,而不排除同时检测其分子成分的可能性(图2)。此外,MV可以通过简单的离心机步骤获得,并且该方法的技术要求通常在大多数基本临床实验室中得到满足。为了进一步促进这种方法,研究人员正在开发一种直接分析患者血清的MV的新系统。
图 2. 指标性MV分析工作流程。EV由HM血液样品分离并通过流式细胞术分析。通过使用尺寸校准珠(0.3,0.9和3μm)和TruCOUNT对照(TC,Becton Dickinson)来限定门区域。MV门、PBS的阴性对照以及来自代表性HM样品的分离的MV的FSC和SSC分别显示在上图中。在下图中,使用特异性抗浆细胞抗原Abs(例如抗CD38和抗CD138Abs)(右图)对MM MV进行免疫分型。相应的isotype Abs显示在左图。Abs, antibodies; FSC, forward scatter; PBS, saline phosphate buffer; SSC, side scatter.
参考文献:Caivano A, Del Vecchio L, Musto P. Do we need to distinguish exosomes from microvesicles in hematological malignancies? Leukemia. 2017 Jun 28. doi: 10.1038/leu.2017.205. [Epub ahead of print] IF=11.702
http://www.exosome.com.cn/thread-1720-1-1.html?_dsign=374ac2e0
外泌体资讯网 Microvesicles与exosomes在血液恶性肿瘤中的作用有什么不同?| Microvesicles同样重要!