作者:企鹅
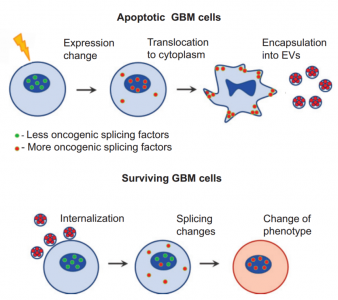
胶质母细胞瘤中的一种令人惊讶的细胞间通讯形式可促进受体细胞的综合改变,包括侵袭性、运动性和对放射或化学疗法的抗性。有意思的是,根据美国、俄罗斯和韩国研究机构的研究小组的研究报道,这种信号传导中的发送细胞是正在经历程序性细胞死亡或细胞凋亡的成胶质细胞瘤细胞。濒临死亡的癌细胞通过细胞凋亡过程中诱导和释放的细胞外囊泡发送信号。这些囊泡——称为外泌体的膜结合小泡——携带改变受体胶质母细胞瘤细胞中RNA剪接的组分,并且这种改变的剪接促进了治疗抗性和侵袭性迁移。因此,该机制成为治疗原发性脑癌胶质母细胞瘤的新疗法的可能靶标,并且该机制也可适用于其他癌症类型。
“临床上,我们的数据可能为RNA剪接事件或特定剪接因子的分子靶向提供基础,从而开发新型癌症治疗方案”Cancer Cell文章的通讯作者Ichiro Nakano博士说。“靶向此过程,可能会使治疗抵抗的获得减少,以及癌细胞迁移的减少。”
Nakano博士是伯明翰阿拉巴马大学(UAB)的学术神经外科医生,负责脑肿瘤转化研究和临床脑肿瘤手术。他是UAB医学院的神经外科教授,也是UAB综合癌症中心的高级科学家。
成胶质细胞瘤侵袭能力强、生长迅速,患者生存率低下。随着癌细胞数量的迅速增加,大量的凋亡肿瘤细胞与相邻的增殖性肿瘤细胞混合在一起。凋亡细胞可占肿瘤细胞群高达70%。
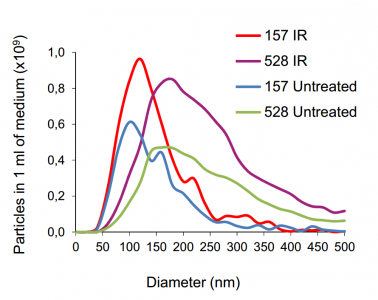
这种不寻常的细胞间通讯的发现开始于一个简单的实验——在小鼠异种移植模型中,注射致死性照射的人类成胶质细胞瘤细胞(使其凋亡)和“健康”成胶质细胞瘤细胞的组合。与“健康”胶质母细胞瘤细胞或单独照射胶质母细胞瘤细胞相比,这种组合导致更具侵袭性的肿瘤生长。该组合也更耐受治疗。UAB的研究人员和同事发现,诱导细胞凋亡后,胶质母细胞瘤细胞分泌的外泌体平均大小明显增加,且数量更多(如下图)。
当与“健康”胶质母细胞瘤细胞组合时,那些凋亡细胞来源的外泌体显著增加异种移植模型中的肿瘤生长和体外实验中的细胞运动性。此外,虽然单独的“健康”胶质母细胞瘤细胞在异种移植物中的肿瘤和相邻正常组织之间具有明确的边界,但与凋亡细胞来源的外泌体共注射的成胶质细胞瘤细胞侵入邻近的脑组织。非凋亡细胞释放的外泌体没有这些作用。
为了发现这些变化的机制,研究人员研究了凋亡细胞外泌体内部的成分。结果发现,这些囊泡富含剪接体蛋白和几种U snRNAs——从信使RNA前体中去除内含子的细胞机制的一部分。这些通常局限于细胞核;但Nakano研究小组发现,随着胶质母细胞瘤细胞发生凋亡,剪切体蛋白被运出细胞核,进入细胞质,最后被包装进囊泡释放。
胶质母细胞瘤细胞亚型包括促神经元亚型和间充质亚型。最近的数据显示,在治疗后,胶质母细胞瘤细胞从不那么侵袭的促神经元亚型转变为更具侵袭性和抗治疗性的间质亚型。研究人员发现凋亡细胞的外泌体在受体细胞中诱导大量的替代性RNA剪接,类似于间充质胶质母细胞瘤亚型中发现的剪接模式。
部分原因是囊泡中包裹着剪接因子RBM11。研究人员发现,外源性RBM11引起受体细胞内源性RBM11的上调和糖酵解的活化。RBM11的过度表达增加了胶质母细胞瘤细胞的迁移。他们还发现RBM11改变了RNA剪接,从而产生促进DNA修复的蛋白质cyclinD1的异构体和具有显著更高的抗凋亡活性的蛋白质MDM4的异构体。这些变化可以使细胞更耐受治疗。对癌症基因组图谱数据库的检查表明,这两种异构体的表达升高与胶质母细胞瘤患者预后不良有关。
凋亡细胞外囊泡(apoEVs)富含剪接体蛋白和U snRNAs
最后,Nakano领导的团队研究了来自匹配患者的原发性和复发性肿瘤的成对胶质母细胞瘤标本。在43对匹配样品中的大部分中,与原始未治疗的肿瘤相比,复发性成胶质细胞瘤中的RBM11蛋白水平明显更高。在另外两个患者队列中,他们发现RBM11水平越高,胶质瘤患者的术后生存率越差。
该研究的摘要
众所周知,侵袭性癌症如胶质母细胞瘤(GBM)中含有与增殖肿瘤细胞相邻混合的凋亡细胞。尽管如此,凋亡和存活的癌细胞之间的细胞间信号传递仍不清楚。这项研究证明凋亡的GBM细胞通过分泌富含剪接体各种组分的凋亡细胞外囊泡(apoEVs)来促进存活肿瘤细胞的增殖和治疗抗性。apoEVs改变受体细胞中的RNA剪接,从而促进其治疗抗性和侵袭性迁移表型。在机理上,将RBM11鉴定为代表性剪接因子,其在治疗后的肿瘤中上调,并且在诱导细胞凋亡时分泌于细胞外囊泡中。一旦被受体细胞摄取,外源性RBM11将MDM4和Cyclin D1的剪接转变为更多致癌异构体的表达。
该研究的Highlights
- apoEVs促进GBM的更具侵袭性和抗治疗表型
- apoEVs特异性富含剪接体蛋白和snRNAs
- apoEVs影响受体GBM细胞中的mRNA剪接
- RBM11部分负责apoEV介导的受体细胞表型变化
新闻来源:University of Alabama at Birmingham
参考文献:
MS et al. (2018) Apoptotic Cell-Derived Extracellular Vesicles Promote Malignancy of Glioblastoma Via Intercellular Transfer of Splicing Factors. Cancer Cell [Epub ahead of print] DOI: https://doi.org/10.1016/j.ccell.2018.05.012.