土豆
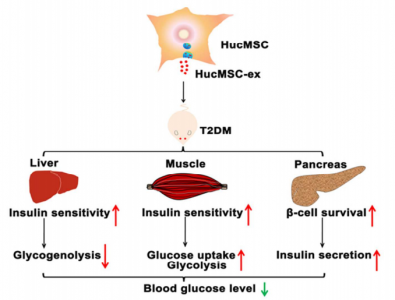
该研究的模式图
外泌体在组织再生和损伤修复方面表现出类似间充质干细胞(MSC)效果。MSC已被证明可以在动物模型和临床试验中减轻糖尿病的症状。在这项研究中,来自江苏大学钱晖、许文荣研究团队在ACS Nano杂志上发表文章发现,来自人脐带MSC(hucMSC-ex)的外泌体对II型糖尿病(T2DM)同样具有治疗效果。
糖尿病是一种影响全世界约5亿人的代谢性疾病。 II型糖尿病(T2DM)占糖尿病病例的95%。外周胰岛素抵抗、胰岛β细胞减少和β细胞功能障碍是T2DM的主要原因,导致葡萄糖水平失控和退行性并发症。每日注射胰岛素和化学药物如磺酰脲、二甲双胍和噻唑烷二酮是目前T2DM的主要治疗方法。然而,这些治疗只能暂时控制血糖水平,而且会造成皮下结节、腹泻和肥胖等副作用。此外,外源性胰岛素给药可能导致β细胞中胰岛素产生和分泌的丧失,使得外周胰岛素抗性并糖尿病并发症的症状愈发加重。
组织和干细胞的移植已被用于糖尿病治疗。然而,组织供源不足和体内干细胞的低存活率使得这些方法不令人满意。来自骨髓、脐带、脂肪等不同组织的间充质干细胞(MSC)在组织再生中具有潜力。静脉输注骨髓来源的MSC可逆转高脂饮食大鼠模型和链脲霉素(streptozotocin,STZ)诱导的T2DM大鼠模型的糖尿病症状,改善胰岛素分泌,激活胰岛素信号传导途径和增加葡萄糖转运蛋白(GLUT)的表达。输注脂肪来源的MSC可以通过促进肝糖原合成和抑制T2DM大鼠肝葡萄糖的产生来显著降低血糖水平。此外,移植人脐带MSC(hucMSC)的T2DM患者显示出相对稳定的血糖水平,一些患者在治疗后25至43个月不再依赖于胰岛素,而其他患者仅需要低剂量的胰岛素。尽管有证据表明MSC可以在体外诱导成胰岛内分泌相关细胞,但也有报道显示MSC不能在体内分化为β细胞,这表明MSC可能主要通过旁分泌作用在T2DM中发挥其活性。
MSC来源的衍生因子在T2DM治疗中具有多种作用。来自BM-MSC的培养基可降低T2DM动物模型中的血糖水平。来自脂肪来源的MSC的条件培养基可以通过上调GLUT4水平和降低白细胞介素6(IL-6)和纤溶酶原激活物抑制剂-1(PAL-1)体外逆转胰岛素抗性。外泌体是细胞分泌的细胞外纳米颗粒,含有生物活性分子,包括蛋白质、脂质和核酸。参与糖尿病葡萄糖代谢的外泌体引起了人们的关注。研究发现,脂肪来源的外泌体可以将miR-99b转移到肝细胞中,从而调节成纤维细胞生长因子21(FGF-21)的表达并参与葡萄糖代谢。已经发现心肌细胞来源的外泌体可以直接将GLUT蛋白和糖酵解酶转移到内皮细胞来调节葡萄糖转运。这些研究表明,携带活性成分的外泌体可能是介导MSC在糖尿病中的治疗效果的关键因子。众所周知,T2DM是一种系统性疾病,常规口服药的治疗效果因“低生物转化”造成水溶性低或清除率高,而外泌体能克服一般纳米颗粒的障碍。在被靶组织或细胞内化摄取之前,外泌体需要逃离肝脏或肾脏的清除,以避免血清蛋白质的吸收,逃避对免疫系统的监视,与血管内皮壁和细胞外基质相互作用。在外泌体克服这些障碍并到达靶组织后,靶细胞内化的外泌体的作用需要逃避胞内体、溶酶体的降解,这也取决于外泌体的大小和结构。外泌体的结构为杯或碟形,大小30-150nm,密度1.13-1.19g/ml,这些特殊特性使它们容易被吸收,容易穿过血脑屏障或者被细胞内化。脂质双层膜可以保护携带组分免于物理环境的降解并提供长期释放效果。这些信息提示外泌体比其他纳米粒子具有更多优势,可能是糖尿病治疗的潜在的“智能”纳米医学。该研究团队以前曾报道hucMSC衍生的外泌体(hucMSC-ex)可以修复肝纤维化、急性肾损伤和皮肤伤口愈合,而且研究人员通过LC/MS-MS鉴定了hucMSC-ex,发现葡萄糖代谢相关蛋白在hucMSC-ex中富集。
因此,研究人员假设hucMSC-ex也可以缓解在hucMSC中观察到的T2DM中的高血糖症。在这项研究中,利用hucMSC-ex来减轻HFD和STZ诱导的T2DM大鼠模型具有可行性和有效性。结果表明静脉输注hucMSC-ex可以通过增强外周器官胰岛素敏感性和减轻胰岛破坏来降低T2DM大鼠的血糖水平。HucMSC-ex可以通过促进肌肉中GLUT4的表达和膜转运以及依赖于胰岛素的肝糖原储存来恢复T2DM的葡萄糖稳态。 HucMSC通过抑制STZ诱导的β细胞凋亡来缓解T2DM中的胰岛素分泌功能障碍。综上所述,HucMSC-ex在T2DM大鼠模型中表现出理想的缓解糖尿病的能力。
参考文献:Sun Y, Shi H, Yin S, Ji C, Zhang X, Zhang B, Wu P, Shi Y, Mao F, Yan Y, Xu W, Qian H. Human Mesenchymal Stem Cell Derived Exosomes Alleviate Type 2 Diabetes Mellitus through Reversing Peripheral Insulin Resistance and Relieving β-Cell Destruction. ACS Nano. 2018 Jul 27.