土豆
由肿瘤相关巨噬细胞和T淋巴细胞组成的免疫微环境对上皮性卵巢癌发展是至关重要的。近日,来自上海交通大学医学院附属新华医院的汪希鹏课题组团队发现,肿瘤相关巨噬细胞衍生的外泌体可转移miRNA(包括miR-29a-3p和miR-21-5p),通过直接靶向CD4 + T细胞中的STAT3协同诱导Treg / Th17细胞失衡。该研究发表于Cancer Immunology Research杂志上(IF 9.188)。
上皮性卵巢癌(EOC)是妇科癌症相关死亡的最常见原因,其特征在于高复发率和有效治疗的缺乏。与其他实体肿瘤不同,EOC细胞通过形成许多结节转移到腹膜腔,这是EOC治疗的主要障碍。在EOC患者的腹膜中发现存在免疫抑制微环境,进一步加剧了肿瘤进展。之前的研究表明,EOC患者的腹膜含有丰富的免疫细胞,其中70%是肿瘤相关巨噬细胞(TAMs)、25%是T细胞。 TAM可通过分泌IL-10来增加调节性T细胞(Tregs)量来促进肿瘤进展,从而说明靶向肿瘤相关免疫细胞之间的关联机制和免疫抑制性微环境可能是用于EOC治疗有效的策略。
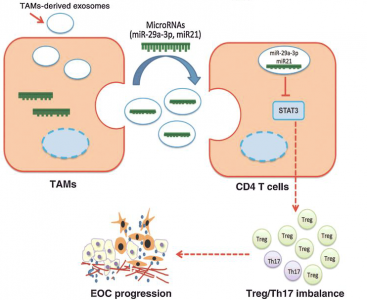
TAMs是肿瘤微环境中的免疫细胞最多的类型,并在肿瘤生长、侵袭、血管生成和转移中发挥重要作用,TAM也影响卵巢癌患者的长期预后。通常,TAM被认为是M2型的具有抗炎和促肿瘤表型。一些研究发现M2 TAMs通过抑制适应性免疫应答在重塑肿瘤微环境(TME)中发挥重要作用。其他研究表明,TAM能够产生外泌体,外泌体是内源性的膜囊泡,大小在30到100nm之间,可将生物材料传递到微环境中的相邻细胞里。已经发现外泌体通过其货物传递信息而成为细胞间通讯的关键参与者,其中包括蛋白质、DNA、mRNA和miRNA。外泌体介导的mRNA和miRNA的转移是细胞之间遗传交换的机制。然而,TAM衍生的外泌体在EOC免疫抑制微环境中的功能仍然未知。
肿瘤微环境中的T细胞显示出较低的抗肿瘤能力并表现出免疫抑制特性。Tregs和T辅助细胞17(Th17)细胞是CD4+ T细胞的两个亚组。Tregs被称为抑制性T细胞,是T细胞亚群之一,可维持对自身抗原的耐受,调节免疫系统并可抑制自身免疫性疾病。Th17细胞是CD4+ 淋巴细胞分泌IL17A并表达转录因子RORγt,调节细胞毒性CD8+ T细胞的活化。Treg / Th17细胞失衡是许多疾病的特征,例如人类系统性狼疮、糖尿病和一些肿瘤。Tregs和Th17细胞共享来自未分化CD4+前体的分化途径。然而,对于影响TME中Tregs和Th17细胞之间失衡的机制知之甚少,特别是在EOC中。
在该研究中,原位和转移性腹膜EOC组织中的Treg / Th17比例显著高于良性卵巢肿瘤和良性腹膜组织。Treg / Th17比例与组织学分级相关,并且是EOC患者总体存活的独立预后因素。在源自TAM的外泌体的微阵列分析的基础上,研究人员鉴定了在外泌体中富集的miRNA,包括miR-29a-3p和miR-21-5p。这两个miRNA模拟物转染到CD4+ T细胞中时,直接抑制STAT3并调节Treg / Th17比例,并且Treg / Th17比例对STAT3抑制具有协同作用。这些结果表明外泌体介导TAM和T细胞之间的相互作用,产生促进EOC进展和转移的免疫抑制微环境。这些研究结果表明,靶向这些外泌体或其相关的miRNA可能为开发新的EOC治疗的新方法。
参考文献:Zhou J, Li X, Wu X, Zhang T, Zhu Q, Wang X, Wang H, Wang K, Lin Y, Wang X. Exosomes Released from Tumor-Associated Macrophages Transfer miRNAs That Induce a Treg/Th17 Cell Imbalance in Epithelial Ovarian Cancer. Cancer Immunol Res. 2018 Dec;6(12):1578-1592.