外泌体环状RNA(circRNAs)在具有高转移的肝细胞癌(HCC)细胞中的作用此前研究较少。近日,来自中山大学附属第三医院陈规划、杨扬、张琪课题组的研究人员在EBioMedicine杂志上发表文章发现,高转移性肝癌细胞可通过分泌含有circPTGR1的外泌体,促进较低转移或无转移潜能细胞的转移侵袭能力。
肝细胞癌(HCC)是中国第五大常见癌症,也是全球癌症相关死亡的第三大原因,每年导致60万人死亡。HCC的高发病率(每10万居民16例)和预后不良给社会造成了巨大的经济负担。因此迫切需要更好地寻找和理解HCC病理学以及候选生物标志物,以获得早期检测和预后以及开发治疗策略。
外泌体是小的细胞外囊泡(直径30-150nm),具有完整的脂质双层膜结构。它们来源于胞内体,能够从亲代细胞中分泌并包裹诸如脂质、RNA、DNA和蛋白质的货物。有证据表明外泌体几乎存在于所有哺乳动物细胞中,包括肿瘤细胞。RNA和蛋白质组学分析阐明了肿瘤来源的外泌体在肿瘤发展和进展中所起的作用。研究发现,HCC中的外泌体microRNA(miRNA)在供体H3B细胞和受体HepG2细胞之间存在差异表达,并发现HCC细胞衍生的外泌体下调肝癌发生相关的TAK1激酶以及其相关的信号通路,促进HepG2细胞生长。一项表征外泌体RNA和蛋白质组含量的研究表明,来自转移性HCC细胞系的外泌体可以增强肝细胞运动能力。
环状RNA(circRNA)是一类具有细胞类型特异性表达的内源性非编码RNA,其作为miRNA海绵起调节基因表达的作用。一般认为circRNA是由前体mRNA剪接过程中外显子或内含子的回复产生的。然而,与线性转录物不同,circRNA缺乏5'帽和3'多腺苷酸化尾巴,使得它们比线性mRNA对RNA酶更具耐受力。最近的一项研究表明,circRNA在来自肝癌细胞的外泌体中丰富且稳定,并且已经表明circRNA的表达受核内核酸酶活性和外泌体的调节。总之,这些发现表明外泌体circRNA在调节肿瘤进展中可能具有潜在治疗价值,也可能作为诊断HCC的有希望的生物标志物。然而,先前大多数对HCC外泌体的研究都集中在miRNA和蛋白质上,并且对源自HCC细胞的外泌体circRNA的功能作用的研究较少。
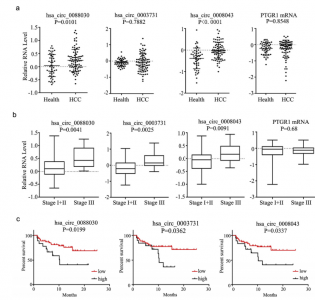
在本研究中,研究人员的目的是研究HCC衍生的外泌体的RNA谱和HCC外泌体circRNA在肿瘤细胞迁移和侵袭中的潜在作用,并阐明其潜在机制。首先,研究人员选取了非转移性(HepG2)、低转移性(97L)和高转移性(LM3)潜力的HCC细胞,对它们的外泌体circRNA进行测序。同时检测来自HCC患者的血清中的转移相关的circRNA并评估它们与临床预后的关联。此外还验证了LM3衍生的外泌体中的候选功能性circRNA。最终发现,LM3外泌体增强HepG2和97L细胞的细胞迁移和侵袭能力。 CircPTGR1是一种具有三种亚型的circRNA,在97L和LM3细胞的外泌体中特异性表达,在HCC患者的血清外泌体中上调,并与临床分期和预后相关。敲除circPTGR1抑制了与LM3外泌体共培养诱导的HepG2和97L细胞的迁移和侵袭。生物信息学、共表达分析和荧光素酶测定表明circPTGR1与MET竞争靶向miR-449a。因此,研究人员认为,较高转移性的HCC细胞可通过含circPTGR1的外泌体赋予较低转移或无转移潜能细胞的迁移和侵袭能力增强。
图:HCC患者血清circPTGR1高表达并预测不良预后。
参考文献:Wang G, Liu W, Zou Y, Wang G, Deng Y, Luo J, Zhang Y, Li H, Zhang Q, Yang Y, Chen G. Three isoforms of exosomal circPTGR1 promote hepatocellular carcinoma metastasis via the miR449a-MET pathway. EBioMedicine. 2019 Jan 7. doi: 10.1016/j.ebiom.2018.12.062.
外泌体资讯网 EBioMedicine:中山大学附属第三医院陈规划课题组发现外泌体circRNA促进MET介导的肝细胞癌转移