食管癌在男性中的发病率是全女性的三到四倍,但在女性中发病率仍然很高。除了外在的环境因素外,性别特异性的内在遗传因素的对女性食管癌的发病也起到了关键作用。近日,来自苏州大学医学部周翊峰课题组的研究人员发现,外泌体lncRNA FMR1-AS1(源于X染色体)在维持食管癌中肿瘤干细胞的动态转换中的作用起到重要作用,揭示了功能性外泌体lncRNA可能作为食管癌精确治疗的有吸引力的靶点。该研究发表于Molecular Cancer(IF 7.776)杂志上。
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是食管癌的主要组织类型,是侵袭性最高的癌症类型之一,也是中国第二大常见癌症类型。虽然,食管癌在男性中的发病率是女性的三到四倍,但食管癌发病率在女性中排名同样在前6位,甚至超过了一些女性特异的癌症类型。目前关于在ESCC发病率中观察到的性别差异,其流行病学研究的关注点通常是一些外在环境因素,例如烟草使用和饮酒。然而,基于性别的ESCC发病率的内在分子和遗传因素仍然未知,特别是在女性患者中。性染色体X携带约2000个基因,占女性总DNA的约5%,男性占2.5%,包括大量非编码RNA。LncRNA参与基因表达的多过程调节,包括通过募集染色质修饰复合物的转录调节和通过与miRNA、mRNA或蛋白质相互作用的转录后调节。LncRNAs可以调节癌症的许多进程,包括增殖、细胞凋亡、转移和新陈代谢等。然而,X染色体相关的lncRNA在女性特异性ESCC中的作用尚未有定论。
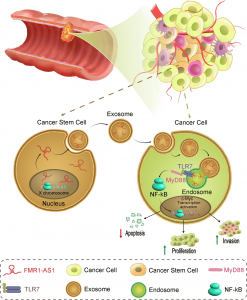
外泌体在多泡体中产生并且可以从多种类型的细胞中分泌,通过传递细胞内货物(例如蛋白质和核酸)参与细胞间通讯。据报道,许多lncRNA可以在肿瘤细胞之间转移,如人宫颈癌和乳腺癌来源的外泌体可以传递肿瘤信号和表型。然而,源自ESCC细胞的外泌体lncRNA的功能仍然是未知的。新出现的证据表明,肿瘤微环境中肿瘤干细胞(CSCs)与非肿瘤干细胞(non-CSCs)之间的交互作用在CSCs和non-CSCs动态平衡中起关键作用。CSC并不是一种通过不对称细胞分裂行使肿瘤发生能力的静态细胞群,而是一种具有高度动态平衡状态的细胞群,其可以通过成熟肿瘤细胞的去分化而形成。CSC和non-CSC处于动态平衡状态:CSC在某些情况下分化为non-CSC,而non-CSC可以去分化为CSC。然而,分化的non-CSC和CSC之间的相互转化的细胞和分子机制并不明确。由肿瘤细胞分泌的外泌体提供了将各种细胞内分子转移到周围细胞中的方法,这些分子发挥了调节作用,并且可以作为与CSC、non-CSC和肿瘤微环境中的其他细胞通信的重要分子信息载体。肿瘤细胞衍生的外泌体存在于所有体液中,与靶细胞接触后,外泌体可以改变受体的表型和功能属性,将受体细胞重新编程为肿瘤生长、转移和免疫抑制的活跃状态。然而,外泌体特别是外泌体中的lncRNAs在CSC和non-CSC之间的相互转换中的作用很少被研究。
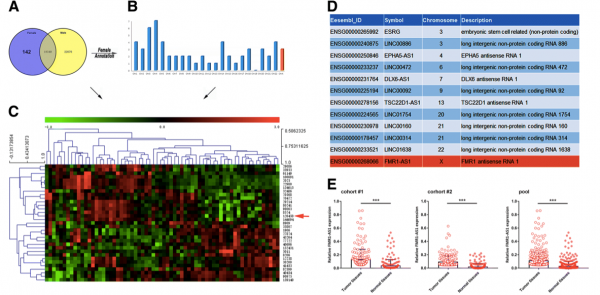
图:Female specific X-associated lncRNA screening
研究人员在179名ESCC患者样本上进行了微阵列分析,并鉴定了女性特异性差异表达的lncRNA。结果发现,FMR1-AS1表达异常并且与女性ESCC患者的sXCI水平密切相关,并且FMR1-AS1过表达可能与不良临床结果相关。 ChIRP-MS数据表明FMR1-AS1可以包装到外泌体中并释放到肿瘤微环境中。功能研究表明,FMR1-AS1可与TLR7结合,激活下游TLR7-NFκB信号,促进c-Myc表达,从而诱导ESCC细胞增殖、抗凋亡和侵袭能力。外泌体共培养和异种移植实验表明含FMR1-AS1的外泌体可以从ESCC CSC分泌,将干细胞表型转移到肿瘤微环境中的non-CSC表型细胞中。此外,FMR1-AS1在血清中的水平与女性ESCC患者的总体存活(OS)之间存在相关性。
总而言之,这项研究揭示了外泌体FMR1-AS1通过激活TLR7-NFκB信号传导的机制维持CSC动态转换状态,上调受体细胞中c-Myc水平,这可能会成为女性食管癌患者精准治疗的有吸引力的方法。
参考文献:Li W, Zhang L, Guo B, Deng J, Wu S, Li F, Wang Y, Lu J, Zhou Y. Exosomal FMR1-AS1 facilitates maintaining cancer stem-like cell dynamic equilibrium via TLR7/NFκB/c-Myc signaling in female esophageal carcinoma. Mol Cancer. 2019 Feb 8;18(1):22.